| Азулен | |
|---|---|
 | |
 | |
 | |
| Общие | |
| Систематическое наименование |
Азулен |
| Хим. формула | С10Н8 |
| Физические свойства | |
| Молярная масса | 128,17 г/моль |
| Термические свойства | |
| Т. плав. | 99 °C |
| Т. кип. | 242 °C |
| Классификация | |
| Рег. номер CAS | 275-51-4 |
| PubChem | 9231 |
| Рег. номер EINECS | 205-993-6 |
| SMILES | |
| InChI | |
| RTECS | CO4570000 |
| ChEBI | 31249 |
| ChemSpider | 8876 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Азуле́н — С10Н8 — бицикло-[5.3.0]-дека-1,3,5,7,9-пентаен — небензоидное ароматическое соединение, содержащее конденсированную систему из 5- и 7-членного циклов. Является изомером нафталина.
История открытия
Азулен впервые был получен в 15 веке в виде синего красящего вещества, выделенного из эфирного масла ромашки. Тогда ему не придали значения, а вещество не идентифицировали. Вторично азулен был обнаружен в 1863 году французским парфюмером Септимусом Пьессом в тысячелистнике и полыни. Тогда же он и получил своё название. Открыл структуру азулена и осуществил его первый синтез швейцарский химик-органик Леопольд (Лавослав) Ружичка в 1937 году.
Нахождение в природе
Производные азулена достаточно широко встречаются в природных эфирных маслах[1]:
- Хамазулен 1,4-диметил-7-этилазулен: компонент эфирного масла из ромашки аптечной (Matricaria chamomilla) [syn. Matricaria recutita] и тысячелистника обыкновенного (Achillea millefolium).
- Гвайазулен 1,4-диметил-7-изопропилазулен: входит в состав эфирного масла некоторых эвкалиптов; выделяется из высококипящих фракций эфирного масла Eucalyptus globulus, гурьюн-бальзама, реюньонской герани, Geranium macrorrhizum и пачули.
- Изогвайазулен 2,4-диметил-7-изопропилазулен. Найден в эфирном масле тысячелистника обыкновенного (Achillea millefolium).
Физические свойства
Кристаллическое вещество синего или сине-фиолетового цвета. Нерастворим в воде, растворим в углеводородах, диэтиловом эфире, этаноле. Перегоняется с паром[2].
Хорошо растворяется в серной и фосфорной кислоте с образованием солей (при этом его синяя окраска исчезает). Легко образует π-комплексы с пикриновой кислотой и тринитробензолом.
Молекула обладает дипольным моментом.
Химические свойства
- При нагревании свыше 300 °C изомеризуется в нафталин.
- Постепенно окисляется кислородом воздуха, а при действии KMnO4 в кислой среде расщепляется до смеси жидких и газообразных продуктов.
- В реакциях электрофильного и радикального замещения ведет себя подобно высокоактивным пятичленным гетероциклам.
Вследствие высокой электронной плотности на 5-членном цикле, азулен обладает относительно высокой химической активностью, легко вступая в реакции с электрофильными агентами.
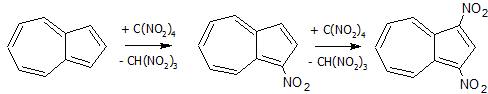
Относительно легко нитруется тетранитрометаном в среде пиридина:
В реакциях галогенирования, ацилирования, азосочетания и др. замещение идет в положение 1 и затем 3:
- В реакциях с нуклеофилами азулен менее активен, замещение идет в положение 4, 8 и далее в 6.
Получение
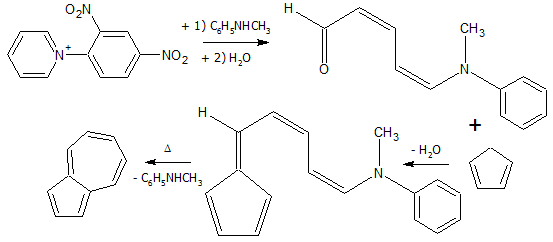
- Из солей пиридиния[2]:
- По реакции 1,1-тиофендиоксида с диметиламинофульвеном[3]:
Применение
Азулен и, особенно, его природные производные достаточно широко используются в парфюмерии и косметике: входят в состав зубных паст, кремов, шампуней и других средств ухода за телом.
Физиологическая роль
Азулены обладают противовоспалительной, антиаллергенной и бактериостатической активностью, на чём и основано их применение.
Примечания
Ссылки
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .