| Бензилхлорид | |
|---|---|
 | |
 | |
| Общие | |
| Традиционные названия | бензилхлорид, хлорметилбензол, α-хлортолуол |
| Хим. формула | C6H5CH2Cl |
| Рац. формула | C7H7Cl |
| Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 126,58 г/моль |
| Плотность | 1,100 г/см³ |
| Термические свойства | |
| Т. плав. | −39 °C |
| Т. кип. | 179,3 °C |
| Т. всп. | 153 ± 1 градус Фаренгейта[1] |
| Пр. взрв. | 1,1 ± 0,1 об.%[1] |
| Давление пара | 1 ± 1 мм рт.ст.[1] |
| Химические свойства | |
| Растворимость в воде | не растворим |
| Растворимость в спирт | смешивается |
| Растворимость в хлороформ | смешивается |
| Растворимость в орг. растворители | смешивается |
| Оптические свойства | |
| Показатель преломления | 1,5391 |
| Классификация | |
| Рег. номер CAS | 100-44-7 |
| PubChem | 7503 |
| Рег. номер EINECS | 202-853-6 |
| SMILES | |
| InChI | |
| RTECS | XS8925000 |
| ChEBI | 615597 |
| Номер ООН | 1738 |
| ChemSpider | 13840690 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Бензилхлорид (хлористый бензил) — бесцветная жидкость с резким запахом, нерастворимая в воде, смешивается с этанолом, хлороформом и другими органическими растворителями. Лакриматор, огнеопасен.
Получение
В промышленности бензилхлорид получают жидкофазным радикальным хлорированием толуола:
Таким способом получают около 100,000 тонн бензилхлорида в год[2]. Побочными продуктами являются бензальхлорид и бензотрихлорид (C6H5CHCl2 и C6H5CCl3).
Существует несколько вариантов процесса: хлорирование толуола в присутствии 1 % PCI3 при 90—100 °C, хлорирование при УФ-облучении или в присутствии 2,2'-азо-бис-изобутиронитрила.
Кроме хлорирования при высокой температуре, реакция прекрасно протекает и при комнатной в отсутствие катализаторов при простом пропускании хлора в толуол, находящийся по возможности в высоком сосуде для более эффективного растворения газа, на солнечном свету(предпочтительно) или при искусственном освещении. При данном способе хлорирования, содержание влаги в толуоле и хлоре не оказывает сколько-нибудь заметного влияния на скорость реакции. Существует и ещё более простой оригинальный метод получения бензилхлорида в лаборатории — хлорирование толуола на поверхности раствора гипохлорита натрия или кальция (хлорной извести), введением по трубке доходящей до дна сосуда раствора соляной или серной кислоты в раствор гипохлорита. Образующийся хлор эффективно экстрагируется находящимся на поверхности слоем толуола(достаточно толщины слоя в 3-4 см) и при освещении этого слоя быстро происходит реакция. Реакция проводится также при комнатной температуре.
Бензилхлорид также может быть получен хлорированием толуола сульфурилхлоридом SO2Cl2, хлорметилирование по Блану бензола:
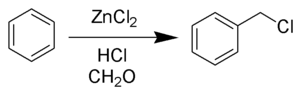
В лаборатории получают реакцией бензилового спирта с концентрированной соляной кислотой
Применение и реакции
- Бензилхлорид применяют для получения бензилового спирта и особенно бензилцеллюлозы (см. Целлюлоза), широко используемой в производстве пластических масс, плёнок, электроизоляционных покрытий и лаков.
- В промышленности бензилхлорид играет роль прекурсора к бензиловым эфирам, которые используются как пластификаторы, ароматизаторы и парфюмерия.
- Фенилуксусную кислоту, прекурсор к фармацевтическим препаратам, получают через бензилцианид, который образуется при обработке бензилхлорида цианидом натрия.
- Четвертичные аммониевые соли, используемые в качестве поверхностно-активных веществ, легко образуются алкилированием третичного амина бензилхлоридом:
- В органическом синтезе, бензилхлорид используется для введения бензильной защитной группы, получая соответствующий бензиловый эфир. Снимается данная группа гидрированием на палладии.
- С карбоновыми кислотами, даёт соответствующие бензильные сложные эфиры[3].
- Бензойная кислота (C6H5COOH) может быть получена окислением бензилхлорида щелочным раствором перманганата калия (KMnO4).
- Он может быть использован в синтезе наркотиков класса амфетаминов, и по этим причинам продажи бензилхлорида находятся под мониторингом в США List II
- Бензилхлорид также легко реагирует с металлическим магнием давая реактив Гриньяра. Он предпочтительнее чем бензил бромид для получения реагента Гриньяра, так как бромид даёт в качестве продукта также продукт сочетания по Вюрцу — 1,2-дифенилэтан.
Бензилирование гетероатомных функциональных групп
Бензилхлорид — удобный бензилирующий агент для гетероатомных функциональных групп и наиболее часто используется для введения этой защитной группы[4]. Бензилирование спиртов этим реагентом достигается в условиях катализа сильным основанием таким как KOH, и в спиртовых растворителях[5] и в условиях фазового переноса с n-Bu4NHSO4[6] Оксид серебра в ДМФА также эффективен[7] Фенолы могут также быть бензилированы в условиях основного катализа [8].
Амино группы легко бензилируются при обработке бензилхлоридом в присутствии карбоната или гидроксида[9] при этом дибензилирование является конкурентной реакцией[10]. Тиолы бензилируются в присутствии гидроксида натрия или цезия карбоната и полярных растворителях, таких как этанол или ДМФА[11].
Амиды могут быть N-бензилированы бензилхлоридом при действии сильных оснований таких как метал гидриды[12] 11
Бензилирование метиленактивных соединений
Анионы и дианионы β-кетоэфиров,[13], замещённые малоновые эфиры,[14] β-кетоальдегиды,[15] β-дикетоны,[16] β-кетоамиды,[17] и β-кетонитрилы[18] все эффективно реагируют давая С-бензилированные продукты. Когда генерируется дианион из β-кетоамида, β-кетоэфир или β-дикетоне бензилируется менее кислотное положение. Нитрил стабилизированные карбанионы легко бензилируются в эфирных растворителях, аммиаке или ДМСО[19] Бензилхлорид также реагирует с карбанионами генерированными из кетонов,[20] эфиров[21], иминов (металлоенаминов) и гидразонов[22], оксимы[23].
Безопасность
Бензилхлорид является алкилирующим агентом. Он реагирует с водой, гидролизуясь до бензилового спирта и хлороводорода. Так как бензилхлорид достаточно летуч при комнатной температуре и раздражает слизистые оболочки глаз и кожу, является лакриматором.
Работу с ним ведут в вытяжном шкафу и с соответствующей защитой кожи. Бензилхлорид является мутагеном и, возможно, канцерогеном.
Ссылки
- 1 2 3 http://www.cdc.gov/niosh/npg/npgd0053.html
- ↑ Furniss, B. S.; Hannaford, A. J.; Smith, P. W. G.; Tatchell, A. R. (1989), Vogel’s Textbook of Practical Organic Chemistry (5th ed.), Harlow: Longman, p. 864, ISBN 0-582-46236-3
- ↑ Shaw, J. E.; Kunerth, D. C.; Sherry, J. J. Tetrahedron Lett. 1973, 689.
- ↑ (a) Greene, T. W.; Wuts, P. G. M., Protective Groups in Organic Synthesis, 2nd ed.; Wiley: New York, 1991. (b) Protective Groups in Organic Chemistry, McOmie, J. F. W., Ed.; Plenum: New York, 1973.
- ↑ Fletcher, H. G., Methods Carbohydr. Chem. 1963, 166.
- ↑ Freedman, H. H.; Dubois, R. A. Tetrahedron Lett. 1975, 3251.
- ↑ Kuhn, R.; Löw, I.; Trischmann, H. Chem. Ber. 1957, 90, 203.
- ↑ Heer, J.; Billeter, J. R.; Miescher, K. Helv. Chim. Acta 1945, 28, 991
- ↑ Yamashita, M.; Takegami, Y. Synthesis 1977, 803.
- ↑ Velluz, L.; Amiard, G.; Heymès, R. Bull. Soc. Chim. Fr., Part 2 1954, 1012.
- ↑ (a) Frankel, M.; Gertner, D.; Jacobson, H.; Zilkha, A. J. Chem. Soc. 1960, 1390. (b) Vogtle, F.; Klieser, B. S 1982, 294.
- ↑ (a) Xia, Y.; Kozikowski, A. P. J. Am. Chem. Soc. 1989, 111, 4116. (b) Bryant, D. R.; Work, S. D.; Hauser, C. R. J. Org. Chem. 1964, 29, 235.
- ↑ (a) Elsinger, F. OS 1973, 5, 76. (b) Stork, G.; McElvain, S. M. J. Am. Chem. Soc. 1946, 68, 1053
- ↑ Cope, A. C.; Holmes, H. L.; House, H. O. Org. React. 1957, 9, 107.
- ↑ Ravikumar, V. T.; Sathyamoorthi, G.; Thangaraj, K.; Rajagopalan, K. Indian J. Chem., Sect. B 1985, 24, 959
- ↑ Hauser, C. R.; Harris, T. M. J. Am. Chem. Soc. 1958, 80, 6360.
- ↑ Hubbard, J. S.; Harris, T. M. Tetrahedron Lett. 1978, 4601.
- ↑ Baraldi, P. G.; Pollini, G. P.; Zanirato, V. Synthesis 1985, 969.
- ↑ Arseniyadis, S.; Kyler, K. S.; Watt, D. S. Org. React. 1984, 31, 1.
- ↑ Bates, G. S.; Ramaswamy, S. Can. J. Chem. 1980, 58, 716.
- ↑ Muller-Uri, C.; Singer, E. A.; Fleischacker, W. J. Med. Chem. 1986, 29, 125
- ↑ (a) Stork, G.; Dowd, S. R. J. Am. Chem. Soc. 1963, 85, 2178. (b) Hosomi, A.; Araki, Y.; Sakurai, H. J. Am. Chem. Soc. 1982, 104, 2081
- ↑ Henoch, F. E.; Hampton, K. G.; Hauser, C. R. J. Am. Chem. Soc. 1969, 91, 676.
| Бензилхлорид на Викискладе |
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .

![{\displaystyle {\mathsf {C_{6}H_{5}CH_{2}Cl{\xrightarrow[{}]{NaCN}}C_{6}H_{5}CH_{2}CN{\xrightarrow[{}]{H_{2}O}}C_{6}H_{5}CH_{2}COOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b9c65d785b7a0daac3171ddfe45b74bd18e6a56f)
![{\displaystyle {\mathsf {R_{3}N+C_{6}H_{5}CH_{2}Cl\rightarrow [R_{3}N(C_{6}H_{5}CH_{2})]^{+}Cl^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/60f446137c8a356400fae69c4748bd2f5a8002fb)
![{\displaystyle {\mathsf {C_{6}H_{5}CH_{2}Cl{\xrightarrow[{}]{ROH}}C_{6}H_{5}CH_{2}OR{\xrightarrow[{Pd}]{H_{2}}}ROH+C_{6}H_{5}CH_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5f2481cdd4506614eceefa19048a1478d2126362)
![{\displaystyle {\mathsf {C_{6}H_{5}CH_{2}Cl{\xrightarrow[{OH^{-}}]{KMnO_{4}}}C_{6}H_{5}COOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/49c375ed5f43a9fed9a23a44f89a7f83bdee891a)