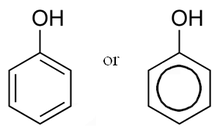
Фено́лы — органические соединения ароматического ряда, в молекулах которых гидроксильные группы OH− связаны с атомами углерода ароматического кольца.
Классификация
По числу ароматических ядер различают собственно фенолы, нафтолы (2 конденсированных ядра), антролы (3 ядра), фенантролы (3 ядра), бензотетролы (4 ядер),
По числу ОН-групп различают:
- одноатомные фенолы (аренолы): фенол (C6H5OH) и его гомологи;
- двухатомные фенолы (арендиолы): пирокатехин, резорцин, гидрохинон (соответственно 1,2-, 1,3- и 1,4-дигидроксибензолы);
- трёхатомные фенолы (арентриолы): пирогаллол, гидроксигидрохинон, флороглюцин (соответственно 1,2,3-, 1,2,4- и 1,3,5-тригидроксибензолы),
- многоатомные фенолы
Изомерия
Возможны 2 типа изомерии:
- изомерия положения заместителей в бензольном кольце;
- изомерия боковой цепи (строения алкильного радикала и числа радикалов).
Электронное строение
Фенолы представляют собой полярные соединения (диполи). Бензольное кольцо является отрицательным концом диполя, группа — OH — положительным. Дипольный момент направлен в сторону бензольного кольца.

Как известно, гидроксильная группа -OH является заместителем I рода, то есть она способствует повышению электронной плотности в бензольном кольце (особенно в орто- и пара-положениях). Это обусловлено тем, что одна из неподелённых пар электронов атома кислорода OH-группы вступает в сопряжение с π-системой бензольного кольца. Смещение неподелённой пары электронов атома кислорода в сторону бензольного кольца приводит к увеличению полярности связи O-H. Таким образом, имеет место взаимное влияние атомов и атомных групп в молекуле фенола. Это взаимное влияние отражается в свойствах фенола.[1]
Во-первых, повышается способность к замещению атомов водорода в орто- и пара-положениях бензольного ядра, и в результате реакций замещения обычно образуются три-замещённые производные фенола.
Во-вторых, увеличение полярности связи O-H под действием бензольного ядра и появление достаточно большого положительного заряда на атоме водорода приводит к тому, что молекулы фенола диссоциируют в водных растворах по кислотному типу.
Фенол является слабой кислотой. В этом состоит главное отличие фенолов от спиртов, которые являются неэлектролитами.
Физические свойства
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления. Фенол C6H5OH (карболовая кислота) — бесцветное кристаллическое вещество на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком.
В живых организмах
Фенол является окончанием боковой группы стандартной аминокислоты тирозина, и поэтому входит в состав практически каждой белковой молекулы[2].
Химические свойства
1. Реакции с участием гидроксильной группы
Кислотные свойства
- Диссоциация в водных растворах с образованием фенолят-ионов и ионов водорода;
- Взаимодействие с щелочами с образованием фенолятов (отличие от спиртов);
- Взаимодействие с активными металлами с образованием фенолятов (образующиеся в результате реакций 2 и 3) феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов, следовательно, фенол — ещё более слабая кислота, чем угольная).
При взаимодействии фенолятов с галогенпроизводными образуются простые и сложные эфиры (реакция Фриделя — Крафтса).
2. Реакции с участием бензольного кольца
Реакции замещения
- Галогенирование (взаимодействие с галогенами)
- Нитрование (взаимодействие с азотной кислотой)
- Сульфирование (взаимодействие с серной кислотой)
Реакции присоединения
- Гидрирование (восстановление водородом до циклогексанола)
Качественные реакции на фенолы
В водных растворах одноатомные фенолы взаимодействуют с хлоридом железа(III) с образованием комплексных фенолятов, которые имеют фиолетовую окраску; окраска исчезает после прибавления синильной кислоты
Способы получения
1. Из каменноугольной смолы. Каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щелочи (образуются феноляты), а затем — кислотой.
2. Сплавление аренсульфокислот со щелочью: C6H5-SO3Na + NaOH → C6H5-OH + Na2SO3
3. Взаимодействие галогенпроизводных ароматических углеводородов со щелочами: C6H5-Cl + NaOH → C6H5-OH + NaCl
или с водяным паром: C6H5-Cl + H2O → C6H5-OH + HCl
Применение фенолов
Фенолы широко применяются в производстве пластмасс, резин, лекарств, моющих средств, ядохимикатов, топлива и др. Основное применение фенолы находят в производстве различных феноло-альдегидных смол, полиамидов, полиарилатов, полиариленсульфонов, поликарбонатов, эпоксидных смол, антиоксидантов, бактерицидов и пестицидов (например, нитрафен). Алкилфенолы используют в производстве ПАВ, стабилизаторов и присадок к топливам. Двухатомные фенолы и их производные входят в состав дубителей для кожи и меха, модификаторов и стабилизаторов резин и каучуков, применяются для обработки кино- и фотоматериалов. В медицине фенолы и их производные используют в качестве антимикробных (фенол, резорцин), противовоспалительных (салол, осарсол), спазмолитических (адреналин, папаверин), жаропонижающих (аспирин, салициловая кислота), слабительных (фенолфталеин), адреномиметических (мезатон), вяжущих (таннины) и других лекарственных средств, а также витаминов E и P.
Литература
Синович А. Д., Павлов Г. П. Фенолы // Химическая энциклопедия: в 5 т / Зефиров Н. С. (гл. ред.). — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан—Ятрохимия. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
Примечания
Ссылки
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .