| |||||
| Внешний вид простого вещества | |||||
|---|---|---|---|---|---|
| Свойства атома | |||||
| Название, символ, номер | Га́фний / Hafnium (Hf), 72 | ||||
| Атомная масса (молярная масса) |
178,49(2)[1] а. е. м. (г/моль) | ||||
| Электронная конфигурация | [Xe]4f14 5d2 6s2 | ||||
| Радиус атома | 167 пм | ||||
| Химические свойства | |||||
| Ковалентный радиус | 144 пм | ||||
| Радиус иона | (+4e) 78 пм | ||||
| Электроотрицательность | 1,3 (шкала Полинга) | ||||
| Электродный потенциал | 0 | ||||
| Степени окисления | 0, 2, 3, 4 | ||||
| Энергия ионизации (первый электрон) |
575,2 (5,96) кДж/моль (эВ) | ||||
| Термодинамические свойства простого вещества | |||||
| Плотность (при н. у.) | 13,31[2] г/см³ | ||||
| Температура плавления | 2506 K (2233 °C, 4051 °F)[2] | ||||
| Температура кипения | 4876 K (4603 °C, 8317 °F)[2] | ||||
| Уд. теплота плавления | 25,1 кДж/моль | ||||
| Уд. теплота испарения | 575 кДж/моль | ||||
| Молярная теплоёмкость | 25,7[3] Дж/(K·моль) | ||||
| Молярный объём | 13,6 см³/моль | ||||
| Кристаллическая решётка простого вещества | |||||
| Структура решётки | гексагональная | ||||
| Параметры решётки | a=3,196 нм; c=5,051 нм[4] | ||||
| Отношение c/a | 1,580 | ||||
| Прочие характеристики | |||||
| Теплопроводность | (300 K) 23,0 Вт/(м·К) | ||||
| Номер CAS | 7440-58-6 | ||||
| 72 | Гафний |
178,49 | |
| 4f145d26s2 | |
Га́фний — химический элемент 4-й группы длиннопериодной формы периодической системы Д. И. Менделеева (по короткой форме периодической системы — побочной подгруппы IV группы), шестого периода, с атомным номером 72. Обозначается символом Hf (лат. Hafnium). Простое вещество — тяжёлый тугоплавкий серебристо-белый металл.
Гафний имеет две модификации. При комнатной температуре гафний обладает гексагональной плотноупакованной кристаллической решёткой. При температуре, равной 2016 К, гафний претерпевает аллотропическое превращение — гексагональная решётка переходит в объёмноцентрированную кубическую решётку.
История открытия и происхождение названия
Элемент был открыт в 1923 году.
Гафний искали среди редкоземельных элементов, так как не было выяснено строение 6-го периода системы Д. И. Менделеева. В 1911 году французский химик Ж. Урбен объявил об открытии нового элемента, названного им кельтием. В действительности он получил смесь, состоящую из иттербия, лютеция и небольшого количества гафния. И только после того, как Н. Бор на основании квантовомеханических расчётов показал, что последним редкоземельным элементом является элемент с номером 71, стало ясно, что гафний — аналог циркония.
Базируясь на выводах Бора, который предсказал его свойства и валентность, в 1923 году Дирк Костер и Дьёрдь де Хевеши систематически проанализировали рентгеноспектральным методом норвежские и гренландские цирконы. Совпадение линий рентгенограмм остатков после выщелачивания циркона кипящими растворами кислот с вычисленными по закону Мозли для 72-го элемента позволило исследователям объявить об открытии элемента, который они назвали гафнием в честь города, где было сделано открытие (лат. Hafnia — латинское название Копенгагена). Начавшийся после этого спор о приоритете между Ж. Урбеном, Н. Костером и Д. Хевеши продолжался длительное время. В 1949 году название элемента «гафний» было утверждено Международной комиссией и принято всюду.
Получение
Среднее содержание гафния в земной коре — около 4 г/т. Ввиду отсутствия у гафния собственных минералов и постоянного сопутствия его цирконию, его получают путём переработки циркониевых руд, где он содержится в количестве 2,5 % от веса циркония (циркон содержит 4 % HfO2, бадделеит — 4—6 % HfO2). В мире в год в среднем добывается около 70 тонн гафния, и объёмы его добычи пропорциональны объёмам добычи циркония. Интересна особенность скандиевого минерала — тортвейтита: в нём содержится гафния в процентном отношении гораздо больше, чем циркония, и это обстоятельство очень важно при переработке тортвейтита на скандий и концентрировании гафния из него.
Мировые ресурсы гафния
Цены на гафний 99 % в 2007 году в среднем составляли $780 за килограмм (по материалам infogeo.ru)
Мировые ресурсы гафния в пересчёте на двуокись гафния несколько превышают 1 миллион тонн. Структура распределения этих ресурсов выглядит приблизительно следующим образом:
- Австралия — более 630 тысяч тонн,
- ЮАР — почти 287 тысяч тонн,
- США — чуть более 105 тысяч тонн,
- Индия — около 70 тысяч тонн,
- Бразилия — 9,88 тысяч тонн.
Подавляющая часть сырьевой базы гафния в зарубежных странах представлена цирконом прибрежных морских россыпей.
Запасы гафния в России и СНГ, по оценкам независимых специалистов, весьма велики и в этом отношении при развитии гафниевой промышленности Россия способна стать безусловным лидером на мировом рынке гафния. Стоит также в связи с этим упомянуть весьма значительные ресурсы гафния на Украине. Основные гафнийсодержащие минералы в России и СНГ представлены лопаритом, цирконом, бадделеитом, редкометалльными щелочными гранитами.
Физические свойства

Гафний — блестящий серебристо-белый металл, твёрдый и тугоплавкий. В мелкодисперсном состоянии имеет тёмно-серый, почти чёрный цвет; матовый[3]. Плотность при нормальных условиях — 13,31 г/см3[2]. Температура плавления составляет 2506 K (2233 °C), кипит при 4876 K (4603 °C)[2].
Гафний обладает высоким сечением захвата тепловых нейтронов — (115 барн у естественной смеси изотопов[5]), тогда как у его химического аналога, циркония, сечение захвата на 3 порядка меньше, около 0,2 барн. В связи с этим цирконий, используемый для создания реакторных ТВЭЛов, должен быть тщательно очищен от гафния.
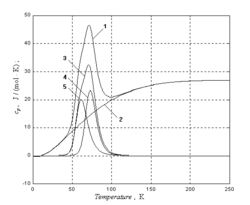
Температурная зависимость теплоёмкости гафния (аналогично теплоёмкости германия — Ge) имеет аномальный вид — на кривой теплоёмкости в диапазоне температур 60—80 К наблюдается пик[6], который не может быть объяснён никакой теорией, предполагающей гуковский закон сил, так как никакая суперпозиция эйнштейновских функций не даёт кривой с максимумом[7]. В данном случае аномальный вид кривой теплоёмкости определяется суперпозицией колебательной (дебаевской) и диффузионной (больцмановской) компонент поглощения тепла кристаллической решеткой[8].
Изотопы гафния
Известно более 30 изотопов гафния. Из них 5 изотопов стабильны и встречаются в природе (176Hf, 177Hf, 178Hf, 179Hf, 180Hf). Благодаря огромному периоду полураспада (период полураспада 2×1015 лет) в природе встречается один нестабильный изотоп, 174Hf.
Известен изомер гафния 178m2Hf. Он привлек внимание общественности в связи с исследованиями агентства оборонных исследований DARPA по принудительному распаду изомера с выделением значительных энергий.[9][10] Начали высказываться гипотезы о возможности построения Гафниевая бомба. Тем не менее в научной среде ставится под сомнение как возможность управляемого взрывного распада 178m2Hf так и возможность получения изомера в количествах, необходимых для создания оружия.
Химические свойства
Гафний, как и тантал, — достаточно инертный материал из-за образования тонкой пассивной плёнки оксидов на поверхности. В целом химическая стойкость гафния гораздо больше, чем у его аналога — циркония.
Лучшим растворителем гафния является фтороводородная кислота (HF) или смесь фтороводородной и азотной кислот, а также царская водка.
При высоких температурах (свыше 1000 К) гафний окисляется на воздухе, а в кислороде сгорает. Реагирует с галогенами. По стойкости к кислотам подобен стеклу. Так же, как и цирконий, обладает гидрофобными свойствами (не смачивается водой).
Важнейшие химические соединения
Соединения двухвалентного гафния
- HfBr2, дибромид гафния — твёрдое вещество чёрного цвета, самовоспламеняющееся на воздухе. Разлагается при температуре 400 °C на гафний и тетрабромид гафния. Получают диспропорционированием трибромида гафния в вакууме при нагревании.
Соединения трёхвалентного гафния
- HfBr3, трибромид гафния — чёрно-синее твёрдое вещество. Диспропорционирует при 400 °C на дибромид и тетрабромид гафния. Получают восстановлением тетрабромида гафния при нагревании в атмосфере водорода или с металлическим алюминием.
Соединения четырёхвалентного гафния
- HfO2, диоксид гафния — бесцветные моноклинные кристаллы (плотность — 9,98 г/см³) или бесцветные тетрагональные кристаллы (плотность — 10,47 г/см³). Последние имеют Tпл 2900 °C, малорастворимы в воде, диамагнитны, обладают более осно́вным характером, чем ZrO2 и обнаруживают каталитические свойства. Получают нагреванием металлического гафния в кислороде или прокаливанием гидроксида, диоксалата, дисульфата гафния.
- Hf(OH)4, гидроксид гафния — белый осадок, растворяющийся при добавлении щёлочей и пероксида водорода с образованием пероксогафниатов. Получают глубоким гидролизом солей четырёхвалентного гафния при нагревании или обработкой растворов солей гафния(IV) щёлочами.
- HfF4, тетрафторид гафния — бесцветные кристаллы. Tпл 1025 °C, плотность — 7,13 г/см³. Растворим в воде. Получают термическим разложением соединения (NH4)2[HfF6] в токе азота при 300 °C.
- HfCl4, тетрахлорид гафния — белый порошок, сублимирующийся при 317 °C. Tпл 432 °C. Получают действием хлора на металлический гафний, карбид гафния или смесь оксида гафния(II) с углем.
- HfBr4, тетрабромид гафния — бесцветные кристаллы. Сублимируются при 322 °C. Tпл 420 °C. Получают действием паров брома на нагретую до 500 °C смесь оксида гафния(II) с углем.
- HfI4, тетраиодид гафния — жёлтые кристаллы. Сублимирует при 427 °C и термически диссоциирует при 1400 °C. Получается взаимодействием гафния с иодом при 300 °C.
- Hf(HPO4)2, гидрофосфат гафния — белый осадок, растворимый в серной и фтороводородной кислотах. Получают обработкой растворов солей гафния(IV) ортофосфорной кислотой.
Применение
В этом разделе не хватает ссылок на источники информации. |

Основные области применения металлического гафния — производство сплавов для аэрокосмической техники, атомная промышленность, специальная оптика.
- В атомной технике используется способность гафния к захвату нейтронов, и его применение в атомной промышленности — это производство регулирующих стержней, специальной керамики и стекла (оксид, карбид, борид, оксокарбид, гафнат диспрозия, гафнат лития). Особенностью и преимуществом диборида гафния является очень малое газовыделение (гелий, водород) при «выгорании» бора.
- В оптике применяется оксид гафния в связи с его температурной стойкостью (т. пл. 2780 °C) и очень высоким показателем преломления. Значительную сферу потребления гафния составляет производство специальных марок стекла для волоконно-оптических изделий, а также для получения особо высококачественных оптических изделий, покрытия зеркал, в том числе и для приборов ночного видения, тепловизоров. Схожую область применения имеет и фторид гафния.
- Карбид и борид гафния (т. пл. 3250 °C) находят применение в качестве чрезвычайно износоустойчивых покрытий и производства сверхтвёрдых сплавов. Кроме того, карбид гафния является одним из самых тугоплавких соединений (т. пл. 3960 °C) и используется для производства сопел космических ракет и некоторых конструкционных элементов газофазных ядерных реактивных двигателей.
- Гафний отличает сравнительно низкая работа выхода электрона (3,53 эВ), и поэтому он применяется для изготовления катодов мощных радиоламп и электронных пушек. В то же время это его качество наряду с высокой температурой плавления позволяет использовать гафний для производства электродов для сварки металлов в аргоне и особенно электродов (катодов) для сварки низкоуглеродистой стали в углекислом газе. Стойкость таких электродов в углекислом газе более чем в 3,7 раза выше, чем вольфрамовых. В качестве эффективных катодов с малой работой выхода применяется также гафнат бария.
- Карбид гафния в виде мелкопористого керамического изделия может служить чрезвычайно эффективным коллектором электронов при условии испарения с его поверхности в вакууме паров цезия-133, в этом случае работа выхода электронов снижается менее чем 0,1—0,12 эВ, и этот эффект может быть использован для создания высокоэффективных термоэмиссионных электрогенераторов и частей мощных ионных двигателей.
- На основе диборида гафния и никеля разработано и уже давно используется высокоизносоустойчивое и твёрдое композиционное покрытие.
- Сплавы тантал-вольфрам-гафний являются лучшими сплавами для подачи топлива в газофазных ядерных ракетных двигателях.
- Сплавы титана, легированные гафнием, применяются в судостроении (производство деталей судовых двигателей), а легирование гафнием никеля не только увеличивает его прочность и коррозионную стойкость, но и резко улучшает свариваемость и прочность сварных швов.
- Карбид тантала-гафния. Добавление гафния к танталу резко увеличивает его стойкость к окислению на воздухе (жаростойкость) за счёт образования плотной и непроницаемой плёнки сложных оксидов на поверхности, и, кроме всего, эта плёнка оксидов очень стойка к теплосменам (тепловой удар). Эти свойства позволили создать очень важные сплавы для ракетной техники (сопла, газовые рули). Один из лучших сплавов гафния и тантала для сопел ракет содержит до 20 % гафния. Также следует отметить большой экономический эффект при применении сплава гафний-тантал для производства электродов для воздушно-плазменной и кислородно-пламенной резки металлов. Опыт применения такого сплава (гафний — 77 %, тантал — 20 %, вольфрам — 2 %, серебро — 0,5 %, цезий — 0,1 %, хром — 0,4 %) показал в 9 раз больший ресурс работы по сравнению с чистым гафнием.
- Легирование гафнием резко упрочняет многие сплавы кобальта, очень важных в турбостроении, нефтяной, химической и пищевой промышленности.
- Гафний используется в некоторых сплавах для сверхмощных постоянных магнитов на основе редких земель (в частности, на основе тербия и самария).
- Сплав карбида гафния (HfC, 20 %) и карбида тантала (TaC, 80 %) является самым тугоплавким сплавом (т. пл. 4216 °C). Кроме того, есть отдельные указания на то, что при легировании этого сплава небольшим количеством карбида титана температура плавления может быть увеличена ещё на 180 градусов.
- Добавлением 1 % гафния в алюминий получают сверхпрочные сплавы алюминия с размером зёрен металла 40—50 нм. При этом не только упрочняется сплав, но и достигается значительное относительное удлинение и повышается предел прочности при сдвиге и кручении, а также улучшается вибростойкость.
- Диэлектрики с высокой диэлектрической проницаемостью на основе оксида гафния в течение следующего десятилетия заменят в микроэлектронике традиционный оксид кремния, что позволит достичь гораздо более высокой плотности элементов в чипах[11]. С 2007 года диоксид гафния используется в 45-нм процессорах Intel Penryn[12][13]. Также в качестве диэлектрика с высокой диэлектрической проницаемостью в электронике применяется силицид гафния. Сплавы гафния и скандия применяются в микроэлектронике для получения резистивных пленок с особыми свойствами.
- Гафний используется для производства высококачественных многослойных рентгеновских зеркал.
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047-1078. — DOI:10.1351/PAC-REP-13-03-02.
- 1 2 3 4 5 Hafnium: physical properties (англ.). WebElements. Проверено 17 августа 2013.
- 1 2 Гафний // Химическая энциклопедия: в 5 т / Кнунянц И. Л. (гл. ред.). — М.: Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — С. 504. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
- ↑ Hafnium: crystal structure (англ.). WebElements. Проверено 17 августа 2013.
- ↑ С. С. Бердоносов. Гафний // Физическая энциклопедия : [в 5 т.] / Гл. ред. А. М. Прохоров. — М.: Советская энциклопедия, 1988. — Т. 1: Ааронова — Бома эффект — Длинные линии. — 707 с. — 100 000 экз.
- ↑ Cristescu S., Simon F. // Z.Phys. Chem. 25 B, 273 (1934)
- ↑ Зейтц Ф. Современная теория твёрдого тела. // М.-Л., Госиздат технической литературы, 1949, 736 с.
- ↑ Аномальные пики на кривых теплоёмкости Ge и Hf. //c. 224—228 в кн. Андреев В. Д. Избранные проблемы теоретической физики. — Киев: Аванпост-Прим, 2012.
- ↑ Ошибка Пентагона. Популярная механика (Октябрь 2007). Архивировано 22 августа 2011 года.
- ↑ Индуцированный распад ядерного изомера 178m2Hf и «изомерная бомба». УФН (Май 2005). Архивировано 22 августа 2011 года.
- ↑ SRC говорит о «революции» в полупроводниковой отрасли. iXBT.com (2 февраля 2007). Проверено 17 августа 2013. Архивировано 18 августа 2013 года.
- ↑ Исследования в области диэлектриков High-k и металлических затворов (недоступная ссылка). Intel Corporation. Проверено 17 августа 2013. Архивировано 26 декабря 2012 года.
- ↑ Инновационное решение, которое устраняет ограничения производительности (недоступная ссылка). Intel Corporation. Проверено 17 августа 2013. Архивировано 6 декабря 2012 года.
Литература
- Химия и технология редких и рассеянных элементов. Ч. 2. Под ред К. Большакова. Изд. 2. М.: Высшая школа, 1976.
Ссылки
| Портал «Химия» | |
| Гафний в Викисловаре | |
| Гафний на Викискладе | |
| Проект «Химия» |
- Гафний в Популярной библиотеке химических элементов
- Кельтий // Большая советская энциклопедия : в 66 т. (65 т. и 1 доп.) / гл. ред. О. Ю. Шмидт. — М. : Советская энциклопедия, 1926—1947.
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .

