| |||||
| Внешний вид простого вещества | |||||
|---|---|---|---|---|---|
| Свойства атома | |||||
| Название, символ, номер | Европий / Europium (Eu), 63 | ||||
| Атомная масса (молярная масса) |
151,964(1)[1] а. е. м. (г/моль) | ||||
| Электронная конфигурация | [Xe] 4f7 6s2 | ||||
| Радиус атома | 199 пм | ||||
| Химические свойства | |||||
| Ковалентный радиус | 185 пм | ||||
| Радиус иона | (+3e) 95 (+2e) 109 пм | ||||
| Электроотрицательность | 1,2 (шкала Полинга) | ||||
| Электродный потенциал |
Eu←Eu3+ -1,99 В Eu←Eu2+ -2,80 В |
||||
| Степени окисления | 3, 2 | ||||
| Энергия ионизации (первый электрон) |
546,9 (5,67) кДж/моль (эВ) | ||||
| Термодинамические свойства простого вещества | |||||
| Плотность (при н. у.) | 5,243 г/см³ | ||||
| Температура плавления | 1099 К (826 °C) | ||||
| Температура кипения | 1802 K (1529 °C) | ||||
| Уд. теплота плавления | 9,21 кДж/моль | ||||
| Уд. теплота испарения | 176 кДж/моль | ||||
| Молярная теплоёмкость | 27,656[2] Дж/(K·моль) | ||||
| Молярный объём | 28,9 см³/моль | ||||
| Кристаллическая решётка простого вещества | |||||
| Структура решётки |
кубическая объёмноцентрированая |
||||
| Параметры решётки | 4,581 Å | ||||
| Прочие характеристики | |||||
| Теплопроводность | (300 K) 13,9 Вт/(м·К) | ||||
| Номер CAS | 7440-53-1 | ||||
| 63 | Европий |
151,964 | |
| 4f76s2 | |
Евро́пий — химический элемент с атомным номером 63 и атомной массой 151,964(1) а. е. м., относящийся к группе лантаноидов, а также относящийся к группе редкоземельных элементов. Простое вещество европий, как и другие лантаноиды — мягкий серебристо-белый металл, легко окисляющийся на воздухе.
История
Первыми спектральные линии, отнесённые впоследствии к европию, наблюдали Крукс (1886) и Лекок де Буабодран (1892). Демарсе обнаружил полосу спектра элемента в самариевой земле в 1896 году, а в 1901 году смог выделить элемент, описал его и дал ему название в честь Европы[3].
Нахождение в природе
Месторождения
Европий входит в состав лантаноидов, которые часто встречаются в США, Казахстанe, России, Австралии, Бразилии, Индии, Скандинавии. Крупнейшее в мире месторождение европия находится в Кении[4]. Значительны запасы в глубоководном месторождении редкоземельных минералов у тихоокеанского острова Минамитори в исключительной экономической зоне Японии[5].
Получение
Металлический европий получают восстановлением Eu2O3 в вакууме лантаном или углеродом, а также электролизом расплава EuCl3.
Цены
Европий является одним из самых дорогих лантаноидов[6]. В 2014 году цена металлического европия ЕВМ-1 составляла от 800 до 2000 долларов США за кг, а оксида европия чистотой 99,9 % — около 500 долларов за кг.

Физические свойства
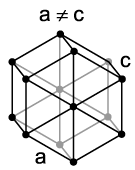
Европий в чистом виде представляет собой, как и другие лантаноиды, мягкий серебристо-белый металл. Он имеет необычно низкие плотность (5,243 г/см3), температуру плавления (826 °C) и температуру кипения (1440 °C) по сравнению со своими соседями по периодической системе элементов гадолинием и самарием. Эти величины противоречат явлению лантаноидного сжатия из-за влияния электронной конфигурации атома европия [Xe] 4f7 6s2 на его свойства. Так как электронная оболочка f атома европия заполнена наполовину, для образования металлической связи предоставлены только два электрона, притяжение которых к ядру ослаблено и приводит к существенному увеличению радиуса атома. Аналогичное явление наблюдается также у атома иттербия. При нормальных условиях европий имеет кубическую объёмно-центрированную кристаллическую решетку с постоянной решетки 4,581 Å. При кристаллизации под высоким давлением европий образует ещё две модификации кристаллической решетки. При этом последовательность модификаций при возрастании давления отличается от такой последовательности у других лантаноидов, что наблюдается также и у иттербия. Первый фазовый переход происходит при давлении свыше 12,5 ГПа, при этом европий образует гексагональную кристаллическую решетку с параметрами a = 2,41 Å и c = 5,45 Å. При давлении свыше 18 ГПа европий образует аналогичную гексагональную кристаллическую решетку с более плотной упаковкой. Ионы европия, встроенные в кристаллическую решетку некоторых соединений, способны вызывать интенсивную флуоресценцию, причем длина волны излучаемого света зависит от степени окисления ионов европия. Eu3+ практически независимо от того вещества, в кристаллическую решетку которого он встроен, испускает свет с длиной волны 613 и 618 нм, что соответствует интенсивному красному цвету. Напротив, максимальная эмиссия Eu2+ сильно зависит от строения кристаллической решетки вещества-хозяина и, например, в случае алюмината бария-магния длина волны испускаемого света составляет 447 нм и находится в синей части спектра, а в случае алюмината стронция (SrAl2O4:Eu2+) длина волны составляет 520 нм и находится в зеленой части спектра видимого света. При давлении 80 ГПа[7] и температуре 1,8 К европий приобретает сверхпроводящие свойства.
Изотопы
Природный европий состоит из двух изотопов, 151Eu и 153Eu, в соотношении примерно 1:1. Европий-153 имеет природную распространённость 52,2 %, он стабилен. Изотоп европий-151 составляет 47,8 % природного европия. Недавно была обнаружена[8] его слабая альфа-радиоактивность с периодом полураспада около 5×1018 лет, что соответствует примерно 1 распаду за 2 минуты в килограмме природного европия. Кроме этого природного радиоизотопа, созданы и исследованы 35 искусственных радиоизотопов европия, среди которых наиболее устойчивы 150Eu (период полураспада 36,9 года), 152Eu (13,516 года) и 154Eu (8,593 года). Обнаружены также 8 метастабильных возбуждённых состояний, среди которых наиболее стабилен 150mEu (12,8 часа), 152m1Eu (9,3116 часа) и 152m2Eu (96 минут)[9].
Химические свойства
Европий является типичным активным металлом и вступает в реакции с большинством неметаллов. Европий в группе лантаноидов имеет максимальную реакционную способность. На воздухе быстро окисляется, на поверхности металла всегда есть оксидная пленка. Хранят в банках или ампулах под слоем жидкого парафина или в керосине. При нагревании на воздухе до температуры 180 °C воспламеняется и горит с образованием оксида европия (III).
Очень активен, может вытеснять из растворов солей почти все металлы. В соединениях, как и большинство РЗЭ, проявляет преимущественно степень окисления +3, при определённых условиях (например, электрохимическим восстановлением, восстановлением амальгамой цинка и др.) можно получить степень окисления +2. Также при изменении окислительно-восстановительных условий возможно получение степени окисления +2 и +3, что соответствует оксиду с химической формулой Eu3O4. С водородом европий образует нестехиометрические фазы, в которых атомы водорода находятся в промежутках кристаллической решетки между атомами европия. Европий растворяется в аммиаке с образованием раствора синего цвета, что обусловлено, как и в подобных растворах щелочных металлов, образованием сольватированных электронов.
Применение
Ядерная энергетика
Европий используется в ядерной энергетике в качестве поглотителя нейтронов (в основном окись европия, гексаборид и борат европия) в атомных реакторах, но окись постепенно «выгорает», и по срокам эксплуатации уступает карбиду бора в 1,5 раза (хотя имеет преимущество в почти полном отсутствии газовыделения и распухания в мощном потоке нейтронов, например, реактор БН-600). Сечение захвата тепловых нейтронов европием (природной смесью изотопов) составляет около 4500 барн, самым активным в отношении захвата нейтронов является европий-151 (9200 барн).
Атомно-водородная энергетика
Оксид европия применяется при термохимическом разложении воды в атомно-водородной энергетике (европий-стронций-йодидный цикл).
Лазерные материалы
Ионы европия служат для генерации лазерного излучения в видимой области спектра с длиной волны 0,61 мкм (оранжевые лучи), поэтому оксид европия используется для создания твердотельных, и менее распространённых жидкостных лазеров.
Электроника
Европий является легирующей примесью в моносульфиде самария (термоэлектрогенераторы), а также как легирующий компонент для синтеза алмазоподобного (сверхтвердого) нитрида углерода.
Силицид европия в виде тонких пленок находит применение в интегральной микроэлектронике.
Моноокись европия, а также сплав моноокиси европия и моноокиси самария применяются в виде тонких пленок в качестве магнитных полупроводниковых материалов для функциональной электроники и, в частности, МДП-электроники.
Люминофоры
- Европий — непременная составляющая люминофоров, используемых в электронно-лучевых и плазменных цветных экранах.
- Купюры евро защищены от подделок люминофорами на основе европия.
- Вольфрамат европия — люминофор, используемый в микроэлектронике.
- Легированный европием борат стронция используется как люминофор в лампах чёрного света.
Медицина
Катионы европия используются в медицинской диагностике в качестве флуоресцентных зондов. Радиоактивные изотопы европия применяются при лечении некоторых форм рака.
Другие сферы применения
- Интенсивно изучаются светочувствительные соединения европия с бромом, хлором и иодом.
- Европий-154 обладает большой мощностью тепловыделения при радиоактивном распаде и предложен в качестве источника в радиоизотопных источниках энергии.
Влияние на качество воды
В реакциях с водой европий химически ведет себя как кальций. При уровнях рН ниже 6 европий способен мигрировать в воде в ионном виде. При более высоких уровнях рН европий образует плохо растворимые и, соответственно, менее подвижные гидроксиды. При контакте с кислородом воздуха происходит дальнейшее окисление до Eu2O3. Максимально наблюдаемые концентрации европия в природных маломинерализованных водах составляют менее 1 мкг/л (в морской воде — 1,1⋅10−6 мг/л). Влияние на качество воды при таких концентрациях представляется незначительным. Предельно допустимая концентрация (ПДК) в воде нормируется только российскими нормами и равна (для питьевой воды) 0,3 мг/л.
Пути поступления в организм
Вероятность попадания европия в организм человека представляется незначительной. Возможно поступление европия в организм с водой в микроскопических количествах. Нельзя исключать вероятности и других путей попадания в организм у людей, сталкивающихся с соединениями европия на производстве.
Потенциальная опасность для здоровья
Европий относится к малотоксичным элементам. Нет какой-либо информации о последствиях воздействия европия на организм человека.
Физиологическое значение
На данный момент нет данных о какой-либо биологической роли европия в организме человека.
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — DOI:10.1351/PAC-REP-13-03-02.
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1990. — Т. 2. — С. 126. — 671 с. — 100 000 экз.
- ↑ Европий // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ Полезные ископаемые Кении
- ↑ The tremendous potential of deepsea mud as a source of rare-earth elements
- ↑ Периодическая таблица элементов — Европий
- ↑ Компьюлента
- ↑ Belli P., Bernabei R., Cappella F., Cerulli R., Dai C., Danevich F., Dangelo A., Incicchitti A., Kobychev V., Nagorny S. S., Nisi S., Nozzoli F., Prosperi D., Tretyak V.I., Yurchenko S.S. (2007). “Search for α decay of natural europium”. Nuclear Physics A. 789: 15—29. Bibcode:2007NuPhA.789...15B. DOI:10.1016/j.nuclphysa.2007.03.001.
- ↑ Nucleonica. Nucleonica: Universal Nuclide Chart. Nucleonica: Universal Nuclide Chart. Nucleonica (2007–2011). Проверено 22 июля 2011.
Ссылки
| Европий в Викисловаре | |
| Европий на Викискладе |
- Данные о европии на сайте WebElements.
- Sinha S.P. Europium. / Springer-Verlag New York Inc., 1967. — 164 p. — (Anorganische und allgemeine Chemie in Einzeldarstellungen. Herausgegeben von Margot Becke-Goehring. Band VIII).
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .


