| Прионы | |
|---|---|
 Гистологический препарат — ткань лобной доли головного мозга больного болезнью Крейтцфельдта — Якоба | |
| МКБ-10 | A81 |
| МКБ-9 | 046 |
Прио́ны (англ. prion от protein «белок» + infection «инфекция»; слово предложено в 1982 году Стенли Прузинером[1]) — особый класс инфекционных агентов, представленных белками с аномальной третичной структурой и не содержащих нуклеиновых кислот. Это положение лежит в основе прионной гипотезы[2], однако насчёт состава прионов есть и другие точки зрения, см. Гипотезы о составе прионов.
Прионы способны увеличивать свою численность, используя функции живых клеток (в этом отношении прионы схожи с вирусами). Прион — это белок с аномальной третичной структурой, способный катализировать конформационное превращение гомологичного ему нормального клеточного белка в себе подобный (прион). Как правило, при переходе белка в прионное состояние его α-спирали превращаются в β-слои. Появившиеся в результате такого перехода прионы могут в свою очередь перестраивать новые молекулы белка; таким образом, запускается цепная реакция, в ходе которой образуется огромное количество неправильно свёрнутых молекул[3]. Прионы — единственные известные инфекционные агенты, размножение которых происходит без участия нуклеиновых кислот.
Все известные прионы вызывают формирование амилоидов — белковых агрегатов, включающих плотно упакованные β-слои. Амилоиды представляют собой фибриллы, растущие на концах, а разлом фибриллы приводит к появлению четырёх растущих концов. Инкубационный период прионного заболевания определяется скоростью экспоненциального роста количества прионов, а она, в свою очередь, зависит от скорости линейного роста и фрагментации агрегатов (фибрилл)[4]. Для размножения приона необходимо исходное наличие нормально уложенного клеточного прионного белка; организмы, у которых отсутствует нормальная форма прионного белка, не страдают прионными заболеваниями.
Прионная форма белка чрезвычайно стабильна и накапливается в поражённой ткани, вызывая её повреждение и, в конечном счёте, отмирание[5]. Стабильность прионной формы означает, что прионы устойчивы к денатурации под действием химических и физических агентов, поэтому уничтожить эти частицы или сдержать их рост тяжело. Прионы существуют в нескольких формах — штаммах, каждый со слегка отличной структурой.
Прионы вызывают заболевания — трансмиссивные губчатые энцефалопатии (ТГЭ) у различных млекопитающих, в том числе губчатую энцефалопатию крупного рогатого скота («коровье бешенство»). У человека прионы вызывают болезнь Крейтцфельдта — Якоба, вариант болезни Крейтцфельдта — Якоба (vCJD), синдром Герстмана — Штраусслера — Шейнкера, фатальную семейную бессонницу и куру[6]. Все известные прионные заболевания поражают головной мозг и другие нервные ткани, в настоящее время неизлечимы и в конечном итоге смертельны[7].
Все известные прионные заболевания млекопитающих вызываются белком PrP. Его форма с нормальной третичной структурой называется PrPC (от англ. common «обычный» или cellular «клеточный»), а инфекционная, аномальная форма называется PrPSc (от англ. scrapie [скрейпи] «почесуха овец», одно из первых заболеваний с установленной прионной природой)[8][9] или PrPTSE (от англ. Transmissible Spongiform Encephalopathies)[10].
Белки, образующие прионы, обнаружены и у некоторых грибов[11]. Большинство прионов грибов не имеют заметного отрицательного влияния на выживаемость, но до сих пор идёт дискуссия о роли грибных прионов в физиологии организма-хозяина и роли в эволюции[12]. Выяснение механизмов размножения прионов грибов оказалось важным для понимания аналогичных процессов у млекопитающих.
В 2016 году появилось сообщение о наличии у растения Arabidopsis thaliana (Резуховидка Таля) белков с прионными свойствами[13][14].
История
Описание прионных заболеваний

Первая открытая трансмиссивная губчатая энцефалопатия — почесуха овец (скрейпи). Первые её случаи были отмечены в Великобритании в 1700-х годах. При этом заболевании овцы страдали от сильнейшего зуда, из-за чего животным приходилось непрерывно тереться (англ. scrape) о деревья, откуда и пошло название болезни. Кроме этого, овцы испытывали боль при движении ногами и страдали от сильнейших припадков. Все эти симптомы являются классическими признаками повреждения мозга, и эта странная болезнь вводила учёных в заблуждение. Гораздо позже, в 1967 году, Чандлер (англ. Chandler) установил, что скрейпи могут болеть и мыши, что, несомненно, было прогрессом в изучении этого заболевания[15].
В двадцатом веке были описаны и прионные заболевания человека. В 1920-х годах Ганс Герхард Крейцфельдт и Альфонс Мария Якоб исследовали новое неизлечимое заболевание нервной системы человека, главным признаком которого было образование полостей в ткани мозга. Впоследствии эта болезнь была названа их именем[15].
В 1957 году Карлтон Гайдузек и Винсент Зигас описали неврологический синдром, распространённый у народа форе, живущего в высокогорьях Папуа — Новой Гвинеи. Эта болезнь характеризовалась тремором, атаксией, на ранних стадиях — атетоидными движениями. К этим симптомам впоследствии прибавлялась слабость, деменция, болезнь неизбежно заканчивалась летальным исходом[15]. На языке форе эта болезнь называется «куру», что в переводе означает «дрожь» или «порча»; под этим названием эта болезнь известна и сегодня. Оказалось, что причиной распространения куру был нередкий среди форе ритуальный каннибализм. В ходе религиозных ритуалов они поедали органы убитых родичей. Мозг при этом ели дети, поскольку считалось, что от него у детей «прибавлялось ума». Инкубационный период заболевания может составлять до 50 лет, однако у девушек, особенно подверженных куру, он может составлять всего лишь четыре года или менее[15]. За открытие инфекционного характера болезни куру Карлтон Гайдузек был удостоен Нобелевской премии по физиологии или медицине в 1976 году[16].
Развитие представлений о прионах

В 1960-х годах в Лондоне два исследователя, радиобиолог Тиква Альпер[en] и математик Джон Стенли Гриффит, выдвинули гипотезу, что некоторые трансмиссивные губчатые энцефалопатии вызываются патогенами, состоящими исключительно из белков[17][18]. Альпер и Гриффит таким образом пытались объяснить тот факт, что таинственный инфекционный агент, вызывающий почесуху овец и болезнь Крейтцфельдта — Якоба, очень устойчив к ионизирующему излучению. Доза радиации, необходимая для уничтожения половины частиц инфекционного агента, зависит от их размера: чем меньше такая частица, тем меньше вероятность попадания в неё заряженной частицы. Так и было установлено, что прион слишком мал для вируса.
Фрэнсис Крик признал важность белковой гипотезы Гриффита для объяснения распространения почесухи овец во втором издании «Центральной догмы молекулярной биологии» (1970). Хотя Крик отстаивал точку зрения, что поток информации от белка к белку или от белка к ДНК или РНК невозможен, он заметил, что гипотеза Гриффита содержала возможное тому противоречие (однако сам Гриффит свою гипотезу так не рассматривал)[19]. Позже он сформулировал свою уточнённую гипотезу с учётом существования обратной транскрипции, открытой в 1970 году Дейвидом Балтимором и Хоуардом Темином.
В 1982 году Стенли Прузинер из Калифорнийского университета в Сан-Франциско сообщил, что его группа выделила гипотетический инфекционный агент (прион) и что он состоит в основном из одного белка (хотя они изолировали этот белок только через два года после сообщения Прузинера)[20]. За свои исследования в области прионов Прузинер в 1997 году был удостоен Нобелевской премии по физиологии или медицине[1].
Структура
Изоформы
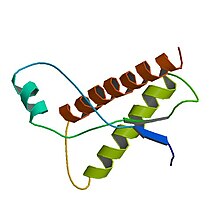
Белок, из которого состоят прионы (PrP), можно найти во всех частях тела у здоровых людей и животных. Однако в поражённых тканях присутствует PrP, имеющий аномальную структуру и устойчивый к протеазам (ферментам, гидролизующим белки). Как сказано выше, нормальная форма называется PrPC, а инфекционная — PrPSc[21]. При определённых условиях можно достичь сворачивания более или менее структурированных изоформ PrP in vitro, которые способны к заражению здоровых организмов, хотя и с меньшей степенью эффективности, чем выделенный из больных организмов[22].
PrPC
PrPC — нормальный мембранный белок млекопитающих, который у человека кодируется геном PRNP. мРНК PRNP человека кодирует полипептид длиной 253 аминокислотных остатка (а. о.), который в процессе созревания укорачивается клеточными ферментами. Зрелая форма PrP состоит из 208 аминокислотных остатков и имеет молекулярную массу 35—36 кДа[23]. Помимо ограниченного протеолиза, PrP подвергается и другим посттрансляционным модификациям: N-гликозилированию по положениям Asn-181 и Asn-197, присоединению гликозилфосфатидилинозитола к Ser-230 и образованию дисульфидной связи между Cys-179 и Cys-214[24]. Аминокислотные остатки, вовлечённые во все перечисленные посттрансляционные модификации, высоко консервативны у млекопитающих[25].
В пространственной структуре PrP выделяют неструктурированный N-концевой участок (а. о. 23—125 у человека) и глобулярный домен (а. о. 126—231), состоящий из трёх α-спиралей и двухцепочечного антипараллельного β-листа[26][27].
Известно несколько топологических форм PrP по отношению к мембране: две трансмембранные и одна закреплённая на мембране гликолипидным якорем[28].
Образование PrPC происходит в ЭПР, дальнейшее созревание — в комплексе Гольджи, откуда он при помощи мембранных везикул доставляется к плазматической мембране. После этого он либо закрепляется на мембране после разрушения эндосомы, либо же подвергается эндоцитозу и разрушается в лизосомах[29].
В отличие от нормальной, растворимой формы белка, прионы осаждаются высокоскоростным центрифугированием, что является стандартным тестом на наличие прионов[8]. PrPC обладает высоким сродством к катионам двухвалентной меди[30]. Значение этого факта неясно, но, возможно, это имеет какое-то отношение к его структуре или функциям. Есть данные, что PrP играет важную роль в прикреплении клеток, передаче внутриклеточных сигналов, а потому может быть вовлечён в коммуникацию клеток мозга[31]. Тем не менее, функции PrP исследованы недостаточно.
PrPSc
Инфекционная изоформа PrP — PrPSc — способна превращать нормальный белок PrPC в инфекционную изоформу, изменяя его конформацию (то есть третичную структуру); это, в свою очередь, изменяет взаимодействия PrP с другими белками. Хотя точная пространственная структура PrPSc неизвестна, установлено, что в ней вместо α-спиралей преобладают β-слои[32]. Такие ненормальные изоформы объединяются в высокоструктурированные амилоидные волокна, которые, скапливаясь, формируют бляшки. Неясно, являются ли эти образования причиной повреждения клеток или всего лишь побочным продуктом патологического процесса[33]. Конец каждого волокна служит своего рода затравкой, к которой могут прикрепляться свободные белковые молекулы, в результате чего фибрилла растёт. В большинстве случаев присоединяться могут только молекулы PrP, идентичные по первичной структуре PrPSc (поэтому обычно передача прионов видоспецифична)[8]. Однако, возможны и случаи межвидовой передачи прионов[34].
Механизм размножения прионов


Первой гипотезой, объясняющей размножение прионов без участия других молекул, в частности, нуклеиновых кислот, была гетеродимерная модель[35]. Согласно этой гипотезе, одна молекула PrPSc присоединяется к одной молекуле PrPC и катализирует её переход в прионную форму. Две молекулы PrPSc после этого расходятся и продолжают превращать другие PrPC в PrPSc. Однако модель размножения (репликации) прионов должна объяснять не только механизм размножения прионов, но и то, почему спонтанное появление прионов столь редко. Манфред Эйген (лат. Manfred Eigen) показал, что гетеродимерная модель требует, чтобы PrPSc был фантастически эффективным катализатором: он должен повышать частоту обращения нормального белка в прионную форму в 1015 раз[36]. Такой проблемы не возникает, если допустить, что PrPSc существует только в агрегированной (например, амилоидной) форме, где кооперативность выступает как барьер для спонтанного перехода в прионную форму. Вдобавок к этому, несмотря на приложенные усилия, выделить мономерный PrPSc так и не удалось.
Альтернативная фибриллярная модель предполагает, что PrPSc существует только в виде фибрилл, при этом концы фибрилл связывают PrPС, где он превращается в PrPSc. Если бы это было только так, то численность прионов возрастала бы линейно. Однако по мере развития прионного заболевания наблюдается экспоненциальный рост количества PrPSc и общей концентрации инфекционных частиц[37][38][39]. Это можно объяснить, если принять во внимание разлом фибрилл[40]. В организме разламывание фибрилл осуществляется белками-шаперонами, которые обычно помогают очистить клетку от аггрегированных белков[41].
Скорость роста числа инфекционных частиц прионов в значительной мере определяется величиной квадратного корня из концентрации PrPSc[4]. Продолжительность инкубационного периода определяется скоростью роста, и это подтверждается исследованиями in vivo на трансгенных мышах[4]. Такая же коренная зависимость наблюдается в экспериментах с различными амилоидными белками in vitro[42].
Механизм репликации прионов имеет значение для разработки лекарств. Поскольку инкубационный период прионных заболеваний чрезвычайно долог, эффективному лекарству вовсе необязательно уничтожить все прионы, достаточно лишь снизить скорость экспоненциального роста их количества. Моделирование предсказывает, что самым эффективным препаратом был бы такой, который связывается с концами фибрилл и блокирует их рост[43].
Функции PrP
Одним из объяснений нейродегенерации, вызываемой прионами, может быть нарушение функционирования PrP. Однако нормальная функция этого белка изучена плохо. Данные in vitro указывают на множество разнообразных ролей, а эксперименты на мышах, «нокаутных» по этому гену, дали относительно немного информации, поскольку у этих животных наблюдались лишь малые отклонения от нормы. Недавние исследования, проведённые на мышах, показали, что расщепление PrP в периферических нервах активирует восстановление их миелинового слоя шванновскими клетками и что отсутствие PrP приводит к демиелинизации нервов[44].
В 2005 году было выдвинуто предположение, что в норме PrP играет роль в поддержании долговременной памяти[45]. Кроме того, у мышей, лишённых гена Prnp, наблюдается изменённая гиппокампальная долговременная потенциация[46][47].
В 2006 году учёные из Института биомедицинских исследований Уайтхед показали, что экспрессия гена Prnp в гемопоэтических стволовых клетках необходима для самоподдержания костного мозга. В исследовании было выявлено, что долгоживущие гемопоэтические стволовые клетки несут PrP на клеточной мембране, а кроветворные ткани со стволовыми клетками, лишёнными PrP, имеют большую чувствительность к клеточному истощению[48].
Гипотезы о составе прионов
Согласно наиболее устоявшейся точке зрения, прионы представляют собой чисто белковые инфекционные агенты[11]. Однако у этой гипотезы («чисто белковой» гипотезы) имеются свои недостатки, в связи с чем появились и альтернативные мнения о сущности прионов. Все перечисленные гипотезы рассматриваются ниже.
«Чисто белковая» гипотеза
До открытия прионов считалось, что все инфекционные агенты используют для размножения нуклеиновые кислоты. «Чисто белковая» гипотеза постулирует, что белковая структура может размножаться без участия нуклеиновых кислот. Первоначально считалось, что эта гипотеза противоречит центральной догме молекулярной биологии, согласно которой нуклеиновые кислоты служат единственным способом передачи наследственной информации, однако в настоящее время считается, что хотя прионы способны к переносу информации без участия нуклеиновых кислот, они неспособны передавать информацию на нуклеиновые кислоты[11].
Доказательства, говорящие в пользу «чисто белковой» гипотезы[49]:
- прионные заболевания не удалось достоверно связать ни с вирусными, ни с бактериальными, ни с грибковыми возбудителями, хотя у дрожжей Saccharomyces cerevisiae известны нелетальные прионы, например, Sup35p (см. прионы грибов);
- инфективность прионов, насколько известно, не связана с нуклеиновыми кислотами; прионы устойчивы к нуклеазам и ультрафиолетовому излучению, губительно сказывающихся на нуклеиновых кислотах;
- прионы не вызывают иммунного ответа;
- у организма, заражённого прионом от другого вида, не обнаруживается PrPSc с аминокислотной последовательностью приона вида-донора. Следовательно, репликации приона донора не происходит;
- в семьях с мутацией гена PrP имеют место наследственные прионные заболевания. У мышей с мутацией этого гена тоже развивается прионное заболевание, несмотря на жёсткий контроль условий содержания, исключающий заражение извне;
- животные, не имеющие белка PrPC, не подвержены прионным заболеваниям.
Мультикомпонентная гипотеза
Низкая инфекционность прионов, полученных из чистого белка in vitro привела к появлению так называемой мультикомпонентной гипотезы, которая постулирует, что для образования инфекционного приона требуются другие молекулы-кофакторы[50].
В 2007 году биохимик Surachai Supattapone и его коллеги из Дартмутского колледжа получили очищенные инфекционные прионы из PrPC, соочищающихся липидов с белком и синтетической полианионной молекулы[51]. Они также показали, что полианионная молекула, потребовавшаяся для образования приона, обладала высоким сродством к PrP и образовывала с ним комплексы. Это дало им основания предположить, что в состав инфекционного приона входит не только белок, но и другие молекулы организма, в том числе липиды и полианионные молекулы[52].
В 2010 году Ма Цзиянь (Jiyan Ma) с коллегами из Университета штата Огайо получили инфекционный прион из синтезированного бактериальными клетками рекомбинантного PrP, фосфолипида POPG и РНК, что тоже подтверждает мультикомпонентную гипотезу[53]. Напротив, в других экспериментах из одного только рекомбинантного PrP удалось получить только слабоинфективные прионы[54][55].
В 2012 году Supattapone и коллеги выделили мембранный липид фосфатидилэтаноламин[en] как эндогенный кофактор, который способен катализировать формирование большого количества рекомбинантных прионов различных штаммов без участия других молекул[56]. Они также сообщили, что этот кофактор необходим для поддержания инфекционной конформации PrPSc, а также определяет штаммовые свойства инфекционных прионов[57].
Вирусная гипотеза
«Чисто белковая» гипотеза встретила критику со стороны тех, кто считает, что простейшим объяснением прионных заболеваний является их вирусная природа[58]. Более десяти лет нейрогистолог Йельского университета Лаура Мануелидис (англ. Laura Manuelidis) пытается доказать, что прионные заболевания вызываются неизвестным медленным вирусом. В январе 2007 года она и её коллеги сообщили, что обнаружили вирус в 10 % (или менее) клеток, заражённых скрейпи в культуре[59][60].
Вирусная гипотеза утверждает, что ТГЭ вызываются способными к репликации информационными молекулами (скорее всего, нуклеиновыми кислотами), связывающимися с PrP. Известны штаммы прионов при ТГЭ, в том числе губчатой энцефалопатии крупного рогатого скота и скрейпи, которые характеризуются специфическими биологическими свойствами, что, по мнению сторонников вирусной гипотезы, не объясняется «чисто белковой» гипотезой.
Аргументы, говорящие в пользу вирусной гипотезы[49]:
- вариации между штаммами: прионы различаются по инфективности, инкубационному периоду, симптоматике и скорости развития заболевания, что напоминает различия между вирусами, особенно РНК-содержащими вирусами[en] (вирусы, содержщие РНК в качестве единственного наследственного материала);
- долгий инкубационный период и быстрое развитие симптомов прионных болезней напоминает лентивирусную инфекцию. Например, схожим образом протекает ВИЧ-индуцированный СПИД;
- в некоторых клетках линий, заражённых скрейпи или болезнью Крейтцфельдта — Якоба, были найдены вирусоподобные частицы, не состоящие из PrP[60].
Недавние исследования распространения губчатой энцефалопатии крупного рогатого скота в бесклеточных системах[61] и в химических реакциях с очищенными компонентами[51] чётко свидетельствуют против вирусной природы этого заболевания. Кроме того, против вирусной гипотезы говорит и вышеупомянутая работа Jiyan Ma[53].
Прионные заболевания

| Поражаемые животные | Заболевания |
|---|---|
| овцы, козы | скрейпи[62] |
| коровы | губчатая энцефалопатия крупного рогатого скота (ГЭКРС), или коровье бешенство[62] |
| норки[62] | Трансмиссивная энцефалопатия норок (TME) |
| белохвостый олень, олени, лоси, мулы[62] | Хроническая слабость (CWD) |
| кошки[62] | Губчатая энцефалопатия кошачьих (FSE) |
| антилопа ньяла, орикс, большой куду[62] | Губчатая энцефалопатия экзотических копытных (EUE) |
| страус[63] | Губчатая энцефалопатия (случаи передачи не зафиксированы) |
| человек | болезнь Крейтцфельдта — Якоба (CJD)[62] |
| Ятрогенная болезнь Крейтцфельдта — Якоба (iCJD) | |
| вариант болезни Крейтцфельдта — Якоба (vCJD) | |
| наследственная болезнь Крейтцфельдта — Якоба (fCJD) | |
| спорадическая болезнь Крейтцфельдта — Якоба (sCJD) | |
| синдром Герстмана — Штраусслера — Шейнкера (GSS)[62] | |
| Фатальная семейная бессонница (FFI)[64] | |
| Куру[62] |
Прионы вызывают нейродегенеративные заболевания, так как образуют внеклеточные скопления в центральной нервной системе и формируют амилоидные бляшки, которые разрушают нормальную структуру ткани. Разрушение характеризуется образованием «дыр» (полостей) в ткани, и ткань принимает губчатую структуру из-за формирования вакуолей в нейронах[65]. Другие наблюдаемые при этом гистологические изменения — астроглиоз (увеличение численности астроцитов из-за разрушения близлежащих нейронов) и отсутствие воспалительных реакций[66]. Хотя инкубационный период прионных заболеваний, как правило, очень долог, после появления симптомов болезнь прогрессирует быстро, приводя к разрушению мозга и смерти[67]. Проявляющимися при этом нейродегенеративными симптомами могут быть конвульсии, деменция, атаксия (расстройство координации движений), поведенческие и личностные изменения.
Все известные прионные заболевания, объединяемые под названием «трансмиссивные губчатые энцефалопатии» (ТГЭ), неизлечимы и фатальны[68]. Для мышей была разработана специальная вакцина, возможно, это поможет разработать вакцину против прионных заболеваний и для человека[69]. Кроме того, в 2006 году учёные заявили, что методами генной инженерии ими была получена корова, лишённая необходимого для образования прионов гена, то есть теоретически она обладает иммунитетом к ТГЭ[70]. Этот вывод основан на результатах исследования, что мыши, лишённые прионного белка в нормальной форме, проявляли устойчивость к приону скрейпи[71].
Прионы поражают множество различных видов млекопитающих, и белок PrP очень схож у всех млекопитающих[72]. Из-за небольших различий между PrP у различных видов для прионной болезни передача от одного вида к другому необычна[источник не указан 2008 дней]. Однако вариант человеческого прионного заболевания (болезни Крейтцфельдта — Якоба) вызывается прионом, обычно поражающим коров и вызывающим губчатую энцефалопатию крупного рогатого скота, который передаётся через заражённое мясо[73].
Пути возникновения
Считается, что прионное заболевание может быть приобретено 3 путями: в случае прямого заражения, наследственно или спорадически (спонтанно)[74]. В некоторых случаях для развития болезни требуется комбинация этих факторов[75]. Например, для развития скрейпи необходимо как заражение, так и определённая генотипом чувствительность[76]. В большинстве случаев прионные заболевания возникают спонтанно по невыясненным причинам[77]. На долю наследственных заболеваний приходится около 15 % всех случаев[10]. Наконец, меньшинство являются результатом действия окружающей среды, то есть имеют ятрогенную природу или появляются в результате прионного заражения[10].
Спонтанное возникновение
Спорадическая (то есть спонтанная) прионная болезнь возникает в популяции у случайной особи. Таков, например, классический вариант болезни Крейтцфельдта — Якоба. Существуют две основные гипотезы относительно спонтанного появления прионных болезней. Согласно первой из них спонтанное изменение происходит в самом доселе нормальном белке в мозге, то есть имеет место посттрансляционная модификация[10]. Альтернативная гипотеза гласит, что одна или несколько клеток организма в какой-то момент претерпевают соматическую мутацию (то есть не передающуюся наследственно) и начинают производить дефектный белок PrPSc[78]. Как бы то ни было, конкретный механизм спонтанного возникновения прионных болезней неизвестен[10].
Наследственность

Был идентифицирован ген, кодирующий нормальный белок PrP — PRNP[79], локализованный на 20-й хромосоме. При всех наследственных прионных заболеваниях имеет место мутация этого гена. Было выделено много различных мутаций (около 30[10]) этого гена, и получающиеся при этом мутантные белки более склонны к укладке в ненормальную (прионную) форму[76]. Все такие мутации наследуются аутосомно-доминантно[10]. Это открытие показало дыру в общей теории прионов, гласящей, что прионы могут переводить в прионную форму только белки идентичного аминокислотного состава. Мутации могут иметь место по всему гену. Некоторые мутации приводят к растяжению октапептидных повторов на N-конце белка PrP. Другие мутации, приводящие к появлению наследственной прионной болезни, могут происходить в позициях 102, 117 и 198 (синдром Герстмана — Штраусслера — Шейнкера), 178, 200, 210 и 232 (болезнь Крейтцфельдта — Якоба) и 178 (фатальная семейная бессонница).
Заражение
По данным современных исследований, основной путь приобретения прионных заболеваний — поедание заражённой пищи. Считается, что прионы могут оставаться в окружающей среде в останках мёртвых животных, а также присутствуют в моче, слюне и других жидкостях и тканях тела. Из-за этого заражение прионами может произойти и в ходе пользования нестерильными хирургическими инструментами (об этом см. раздел «Стерилизация»). Они также могут долго сохраняться в почве за счёт связывания с глиной и другими почвенными минералами[80].
Группа исследователей из Калифорнийского университета во главе с нобелевским лауреатом Стенли Прузинером доказала, что прионная инфекция может развиться из прионов, содержащихся в навозе[81]. А поскольку навоз присутствует вокруг многих водоёмов и на пастбищах, это даёт возможность для широкого распространения прионных болезней. В 2011 году было сообщено об открытии прионов, передающихся по воздуху в частицах аэрозоля (то есть воздушно-капельным путём)[82]. Это открытие было сделано в ходе эксперимента на заражённых скрейпи мышах. Также в 2011 году было опубликовано предварительное доказательство того, что прионы могут передаваться с получаемым из мочи человеческим менопаузальным гонадотропином, применяемым для лечения бесплодия[83].
Стерилизация
Размножение инфекционных агентов, содержащих нуклеиновые кислоты, зависит от нуклеиновых кислот. Однако прионы увеличивают свою численность, изменяя структуру нормальной формы белка на прионную. Поэтому стерилизация против прионов должна включать их денатурацию до состояния, в котором бы они были неспособны изменять конфигурацию других белков. Прионы в большинстве своём устойчивы к протеазам, высокой температуре, радиации и хранению в формалине[84], хотя эти меры и снижают их инфективность. Эффективная дезинфекция против прионов должна включать гидролиз прионов или повреждение/разрушение их третичной структуры. Это можно достичь обработкой хлорной известью, гидроксидом натрия и сильнокислыми моющими веществами[85]. Пребывание в течение 18 минут при температуре 134 °C в герметичном паровом автоклаве не может деактивировать прионы[86][87]. Как потенциальный метод для деактивации и денатурации прионов в настоящее время изучается озоновая стерилизация[88]. Ренатурация полностью денатурированного приона до инфективного состояния зафиксирована не была, однако для частично денатурированных прионов в некоторых искусственных условиях это возможно[89].
Прионы и тяжёлые металлы
Согласно недавним исследованиям, нарушение обмена тяжёлых металлов в мозге играет важную роль в нейротоксичности, связанной с PrPSc, хотя с имеющейся на сегодняшний день информацией сложно объяснить механизм, стоящий за всем этим. Есть гипотезы, объясняющие это явление тем, что PrPC играет некоторую роль в метаболизме металлов, и его нарушение из-за агрегации этого белка (в виде PrPSc) в фибриллы вызывает дисбаланс обмена тяжёлых металлов в мозге. Согласно другой точке зрения, токсичность PrPSc усиливается из-за включения в агрегаты PrPC-связанных металлов, что приводит к образованию комплексов PrPSc с окислительно-восстановительной активностью. Физиологическое значение некоторых комплексов PrPC с металлами известно, а значение других — нет. Патологическое действие PrPC-связанных металлов включает индуцированное металлом окислительное повреждение и в некоторых случаях переход PrPC в PrPSc-подобную форму[90].
Потенциальное лечение и диагностика
Благодаря компьютерному моделированию учёным удалось найти соединения, которые могут быть лекарством против прионных заболеваний. Например, одно соединение может связываться с углублением в PrPC и стабилизировать его структуру, снижая количество вредоносных PrPSc[91].
Недавно были описаны антиприонные антитела, способные проходить через гематоэнцефалический барьер и действующие на цитозольные прионы[92].
В последнее десятилетие был достигнут некоторый прогресс в инактивации инфективности прионов в мясе при помощи сверхвысокого давления[93].
В 2011 году было открыто, что прионы могут разлагаться лишайниками[94][95].
Большое практическое значение имеет проблема диагностики прионных заболеваний, в частности, губчатой энцефалопатии крупного рогатого скота и болезни Крейтцфельдта — Якоба. Их инкубационный период составляет от месяца до десятилетий, в течение которых человек не испытывает никаких симптомов, даже если процесс превращения нормальных мозговых белков PrPC в прионы PrPSc уже начался. В настоящее время фактически нет способа обнаружить PrPSc, кроме как при помощи проверки ткани мозга нейропатологическими и иммунногистохимическими методами уже после смерти. Характерной чертой прионных заболеваний является накопление прионной формы PrPSc белка PrP, однако в легко получаемых жидкостях и тканях тела, как кровь и моча, он содержится в очень низких концентрациях. Исследователи пытались разработать метод измерения доли PrPSc, но сейчас по-прежнему нет полностью признанных методов по использованию для этих целей таких материалов, как кровь.
В 2010 году группа исследователей из Нью-Йорка описала способ обнаружить PrPSc даже тогда, когда его доля в ткани мозга равна одной на сто миллиардов (10−11). Этот метод сочетает амплификацию с новой технологией, называемой Surround Optical Fiber Immunoassay (SOFIA) («оптический иммунологический анализ прилежащих волокон»), и некоторыми специфическими антителами против PrPSc. После амплификации с концентрированием всех PrPSc, возможно содержащихся в образце, образец помечается флуоресцентным красителем с антителами для специфичности и в конце загружается в микрокапиллярную трубку. Потом эта трубка помещается в специальный аппарат так, что она оказывается полностью окружённой оптическими волокнами и весь свет, испускаемый на трубку, поглощается красителем, предварительно возбуждённым лазером. Эта техника позволяет обнаружить PrPSc даже после небольшого количества циклов перехода в прионную форму, что, во-первых, снижает возможность искажения результата артефактами эксперимента, и, во-вторых, ускоряет ход процедуры. Исследователи проверяли по этой технике кровь кажущихся здоровыми овец, в действительности заражённых скрейпи. Когда болезнь стала очевидной, был исследован и их мозг. Таким образом, исследователи получили возможность сравнить анализы крови и мозговой ткани животных с симптомами болезни, со скрытой болезнью и неинфицированных. Результаты наглядно показали, что вышеописанная техника позволяет обнаружить PrPSc в организме задолго до появления первых симптомов[96][97].
Антиприонная активность была обнаружена у астемизола[98].
Прионы грибов
| Формирование прионов [PSI+] отменяет накопление красного пигмента, образующегося в результате мутации в гене ade1 (снизу), в результате чего колонии дрожжей становятся белыми (сверху) |
Белки, способные к передаче их конформации по наследству, то есть неменделевской наследственности, были открыты у дрожжей Saccharomyces cerevisiae Ридом Уикнером (англ. Reed Wickner) в начале 1990-х. Из-за сходства с прионами млекопитающих эти альтернативные наследуемые конформации белков были названы прионами дрожжей. Позже прионы были открыты и у гриба Podospora anserina.
Группа Сьюзан Линдквист (англ. Susan Lindquist) из Института Уайтхед показала, что некоторые прионы грибов не связаны с каким-либо болезненным состоянием, а могут играть полезную роль. Однако, исследователи из NIH предоставили аргументы в пользу того, что прионы грибов могут снижать жизнеспособность клеток[99]. Поэтому вопрос о том, являются ли прионы грибов болезнетворными агентами или же они играют некую полезную роль, остаётся нерешённым[100].
По состоянию на 2012 год известно 11—12 прионов у грибов, в том числе: семь у Saccharomyces cerevisiae ([Sup35, Rnq1, Ure2, Swi1, Mot3, Cyc8, Sfp1, Mca1', вакуолярная протеаза B и Mod5) и один у Podospora anserina (НЕТ-s, МАР-киназы).
Из них наиболее хорошо изучен фактор терминации трансляции Sup35 (гомолог eRF3). Клетки, в которых присутствует прионная форма Sup35, называются клетками [PSI+] (см. илл.). Такие клетки имеют изменённое физиологическое состояние и изменённый уровень экспрессии некоторых генов, что позволило выдвинуть гипотезу о том, что у дрожжей образование прионов может играть адаптативную роль[101].
Статья об открытии приона Mca1 была впоследствии отвергнута, так как воспроизвести результаты эксперимента не удалось[102]. Примечательно, что большинство прионов грибов основаны на глутамин/аспарагин-богатых повторах, исключениями являются Mod5 и HET-s.
Исследования прионов грибов убедительно подтверждают «чисто белковую» гипотезу, так как очищенные белки, выделенные из клеток с белками в прионной форме, демонстрировали способность перестраивать белки нормальной формы в прионную in vitro, и при этом свойства данного штамма приона сохраняются. Был также отчасти пролит свет на прионные домены, то есть домены белка, осуществляющие изменение конформации другого белка в прионную. Прионы грибов помогли представить возможный механизм перехода из нормальной формы в прионную, относящийся ко всем прионам, хотя прионы грибов и отличаются от инфекционных прионов млекопитающих отсутствием кофактора, необходимого для размножения. Особенности прионного домена могут варьировать у различных видов. Например, свойства, присущие прионным доменам прионов грибов, не встречаются у прионов млекопитающих.
Как упоминалось выше, прионы грибов, в отличие от прионов млекопитающих, передаются следующему поколению. Иными словами, у грибов существует механизм прионной (белковой) наследственности, который может служить ярким примером истинно цитоплазматического наследования[11].
| Прионы грибов | |||||
|---|---|---|---|---|---|
| Белок | Хозяин | Нормальная функция | Прионная форма | Прионный фенотип | Год открытия |
| Ure2p | Saccharomyces cerevisiae | Репрессор усвоения азота | [URE3] | Способность усваивать уреидосукцинат в качестве источника азота[11] | 1994 |
| Sup35p | S. cerevisiae | Фактор терминации трансляции | [PSI+] | Повышение частоты прочитывания стоп-кодонов | 1994 |
| HET-S | Podospora anserina | Фактор цитоплазматической несовместимости[11] | [Het-s] | Образование гетерокариона только между совместимыми штаммами | 1997 |
| Вакуолярная протеаза B | S. cerevisiae | уменьшение продолжительности жизни клеток, нарушения мейоза | [β] | Нарушения деградации клеточных белков в условиях голода | 2003 |
| MAP-киназы | Podospora anserina | Усиление пигментации, медленный рост | [C] | 2006 | |
| Rnq1p | S. cerevisiae | Фактор, усиливающий образование прионов | [RNQ+], [PIN+] | Способствует агрегации других белков | |
| Mca1* | S. cerevisiae | Предполагаемая каспаза дрожжей | [MCA+] | Неизвестен | 2008 |
| Swi1 | S. cerevisiae | Изменение конформации хроматина | [SWI+] | Плохой рост на некоторых источниках углерода | 2008 |
| Cyc8 | S. cerevisiae | Транскрипционный репрессор | [OCT+] | Дерепрессия транскрипции многих генов | 2009 |
| Mot3 | S. cerevisiae | Ядерный транскрипционный фактор | [MOT3+] | Транскрипционная дерепрессия анаэробных генов | 2009 |
| Sfp1[103] | S. cerevisiae | Предполагаемый регулятор транскрипции | [ISP+] | Антисупрессия | 2010 |
| Mod5[104] | Saccharomyces cerevisiae | [MOD+] | 2012 | ||
' — неподтверждённое открытие.
См. также
Примечания
- 1 2 Stanley B. Prusiner — Autobiography. NobelPrize.org. Проверено 18 июня 2013. Архивировано 14 июня 2013 года.
- ↑ Somerville RA. (2002). “TSE agent strains and PrP: reconciling structure and function”. Trends in Biochemical Sciences. 27 (12): 606—612. PMID 12468229.
- ↑ Aguzzi A (2008). “Unraveling prion strains with cell biology and organic chemistry”. Proceedings of the National Academy of Sciences of the United States of America. 105 (1): 11—2. Bibcode:2008PNAS..105...11A. DOI:10.1073/pnas.0710824105. PMC 2224168. PMID 18172195.
- 1 2 3 Masel J, Jansen VAA, Nowak MA (March 1999). “Quantifying the kinetic parameters of prion replication” (PDF). Biophysical Chemistry. 77 (2—3): 139—152. DOI:10.1016/S0301-4622(99)00016-2. PMID 10326247. Используется устаревший параметр
|month=(справка) - ↑ Christopher M. Dobson (February 2001). “The structural basis of protein folding and its links with human disease” (PDF). Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 356 (1406): 133—45. DOI:10.1098/rstb.2000.0758. PMC 1088418. PMID 11260793. Проверено 2011-11-09. Используется устаревший параметр
|month=(справка) - ↑ CDC — Prion Diseases
- ↑ Prusiner SB (1998). “Prions”. Proceedings of the National Academy of Sciences of the United States of America. 95 (23): 13363—83. Bibcode:1998PNAS...9513363P. DOI:10.1073/pnas.95.23.13363. PMC 33918. PMID 9811807.
- 1 2 3 Krull, Ira S.; Brian K. Nunnally. Prions and mad cow disease. — New York, N.Y : Marcel Dekker, 2004. — P. 6. — ISBN 0-8247-4083-1.
- ↑ Laurén J, Gimbel DA, Nygaard HB, Gilbert JW, Strittmatter SM (February 2009). “Cellular prion protein mediates impairment of synaptic plasticity by amyloid-beta oligomers”. Nature. 457 (7233): 1128—32. Bibcode:2009Natur.457.1128L. DOI:10.1038/nature07761. PMC 2748841. PMID 19242475. Используется устаревший параметр
|month=(справка) - 1 2 3 4 5 6 7 Prion Diseases (Transmissible Spongiform Encephalopathies).
- 1 2 3 4 5 6 Инге-Вечтомов, 2010, с. 298.
- ↑ Lindquist S, Krobitsch S, Li L, Sondheimer N (February 2001). “Investigating protein conformation-based inheritance and disease in yeast”. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 356 (1406): 169—76. DOI:10.1098/rstb.2000.0762. PMC 1088422. PMID 11260797. Проверено 2011-11-09. Используется устаревший параметр
|month=(справка) - ↑ Chernoff Y. O. Are there prions in plants? (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2016. — Vol. 113, no. 22. — P. 6097—6099. — DOI:10.1073/pnas.1605671113. — PMID 27217577.
- ↑ Chakrabortee S., Kayatekin C., Newby G. A., Mendillo M. L., Lancaster A., Lindquist S. Luminidependens (LD) is an Arabidopsis protein with prion behavior. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2016. — Vol. 113, no. 21. — P. 6065—6070. — DOI:10.1073/pnas.1604478113. — PMID 27114519.
- 1 2 3 4 History of prions
- ↑ The Nobel Prize in Physiology or Medicine 1976 (англ.). Нобелевский фонд. Проверено 19 июня 2013. Архивировано 15 октября 2012 года.
- ↑ Alper T, Cramp WA, Haig DA, Clarke MC (May 1967). “Does the agent of scrapie replicate without nucleic acid?”. Nature. 214 (5090): 764—6. Bibcode:1967Natur.214..764A. DOI:10.1038/214764a0. PMID 4963878. Используется устаревший параметр
|month=(справка) - ↑ Griffith JS (September 1967). “Self-replication and scrapie”. Nature. 215 (5105): 1043—4. Bibcode:1967Natur.215.1043G. DOI:10.1038/2151043a0. PMID 4964084. Используется устаревший параметр
|month=(справка) - ↑ Crick F (August 1970). “Central dogma of molecular biology”. Nature. 227 (5258): 561—3. Bibcode:1970Natur.227..561C. DOI:10.1038/227561a0. PMID 4913914. Используется устаревший параметр
|month=(справка) - ↑ Taubes, Gary (December 1986). “The game of name is fame. But is it science?”. Discover. 7 (12): 28—41.
- ↑ Priola SA, Chesebro B, Caughey B (2003). “Biomedicine. A view from the top—prion diseases from 10,000 feet”. Science. 300 (5621): 917—9. DOI:10.1126/science.1085920. PMID 12738843.
- ↑ Barria MA, Mukherjee A, Gonzalez-Romero D, Morales R, Soto C. De novo generation of infectious prions in vitro produces a new disease phenotype. // PLoS Pathog.. — 2009. — Вып. 5(5). — DOI:10.1371/journal.ppat.1000421.
- ↑ Yusa S., Oliveira-Martins J. B., Sugita-Konishi Y., Kikuchi Y. Cellular prion protein: from physiology to pathology // Viruses. — 2012. — Т. 4, вып. 11. — С. 3109—3131. — DOI:10.3390/v4113109. — PMID 23202518.
- ↑ PrP в базе данных UniProt. Проверено 25 июня 2013. Архивировано 2 июля 2013 года.
- ↑ van Rheede T., Smolenaars M. M., Madsen O., de Jong W. W. Molecular evolution of the mammalian prion protein // Mol Biol Evol. — 2003. — Т. 20, вып. 1. — С. 111—121. — PMID 12519913.
- ↑ Riek R., Hornemann S., Wider G., Billeter M., Glockshuber R., Wüthrich K. NMR structure of the mouse prion protein domain PrP(121-231) // Nature. — 1996. — Т. 382, вып. 6587. — С. 180—182. — PMID 8700211.
- ↑ Ronga L., Tizzano B., Palladino P., Ragone R., Urso E., Maffia M., Ruvo M., Benedetti E., Rossi F. The prion protein: Structural features and related toxic peptides // Chem Biol Drug Des. — 2006. — Т. 68, вып. 3. — С. 139—147. — PMID 17062011.
- ↑ Hegde RS, Mastrianni JA, Scott MR; et al. (1998). “A transmembrane form of the prion protein in neurodegenerative disease”. Science. 279 (5352): 827—34. Bibcode:1998Sci...279..827H. DOI:10.1126/science.279.5352.827. PMID 9452375.
- ↑ Liberski PP, Brown DR, Sikorska B, Caughey B, Brown P. Cell death and autophagy in prion diseases (transmissible spongiform encephalopathies). // Folia Neuropathol.. — 2008. — № 46(1). — P. 1—25.
- ↑ Brown DR, Qin K, Herms JW; et al. (1997). “The cellular prion protein binds copper in vivo”. Nature. 390 (6661): 684—7. Bibcode:1997Natur.390..684B. DOI:10.1038/37783. PMID 9414160.
- ↑ Málaga-Trillo E, Solis GP, Schrock Y; et al. (March 2009). Weissmann, Charles, ed. “Regulation of embryonic cell adhesion by the prion protein”. PLoS Biology. 7 (3): e55. DOI:10.1371/journal.pbio.1000055. PMC 2653553. PMID 19278297. Проверено 2010-02-28. Используется устаревший параметр
|month=(справка) - ↑ Pan KM, Baldwin M, Nguyen J; et al. (December 1993). “Conversion of alpha-helices into beta-sheets features in the formation of the scrapie prion proteins”. Proceedings of the National Academy of Sciences of the United States of America. 90 (23): 10962—6. Bibcode:1993PNAS...9010962P. DOI:10.1073/pnas.90.23.10962. PMC 47901. PMID 7902575. Используется устаревший параметр
|month=(справка) - ↑ Baker, Harry F., and Rosalind M. Ridley, eds. Prion diseases. Totowa, N.J: Humana, 1996
- ↑ Grassmann A, Wolf H, Hofmann J, Graham J, Vorberg I. Cellular aspects of prion replication in vitro. // Viruses.. — 2013. — Вып. 5(1). — С. 374—405. — DOI:10.3390/v5010374..
- ↑ Cohen FE, Pan KM, Huang Z, Baldwin M, Fletterick RJ, Prusiner SB (1994). “Structural clues to prion replication”. Science. 265 (5178): 530—531. Bibcode:1994Sci...264..530C. DOI:10.1126/science.7909169. PMID 7909169.
- ↑ Eigen M (1996). “Prionics or the kinetic basis of prion diseases”. Biophysical Chemistry. 63 (1): A1—18. DOI:10.1016/S0301-4622(96)02250-8. PMID 8981746.
- ↑ Bolton DC, Rudelli RD, Currie JR, Bendheim PE (1991). “Copurification of sp33-37 and scrapie agent from hamster brain prior to detectable histopathology and clinical-disease”. Journal of General Virology. 72 (12): 2905—2913. DOI:10.1099/0022-1317-72-12-2905. PMID 1684986.
- ↑ Jendroska K, Heinzel FP, Torchia M, Stowring L, Kretzschmar HA, Kon A, Stern A, Prusiner SB, DeArmond SJ (1991). “Proteinase-resistant prion protein accumulation in syrian-hamster brain correlates with regional pathology and scrapie infectivity”. Neurology. 41 (9): 1482—1490. PMID 1679911.
- ↑ Beekes M, Baldauf E, Diringer H (1996). “Sequential appearance and accumulation of pathognomonic markers in the central nervous system of hamsters orally infected with scrapie”. Journal of General Virology. 77 (8): 1925—1934. DOI:10.1099/0022-1317-77-8-1925. PMID 8760444.
- ↑ Bamborough P, Wille H, Telling GC, Yehiely F, Prusiner SB, Cohen FE (1996). “Prion protein structure and scrapie replication: theoretical, spectroscopic, and genetic investigations”. Cold Spring Harbor Symposium on Quantitative Biology. 61: 495—509. DOI:10.1101/SQB.1996.061.01.050. PMID 9246476.
- ↑ Winkler J, Tyedmers J, Bukau B, Mogk A. Chaperone networks in protein disaggregation and prion propagation. // J Struct Biol.. — 2012. — Вып. 179(2). — С. 152—60.. — DOI:10.1016/j.jsb.2012.05.002..
- ↑ Knowles TPJ, Waudby CA, Devlin GL, Cohen SIA, Aguzzi A, Vendruscolo M, Terentjev EM, Welland ME, Dobson CM (2009). “An Analytical Solution to the Kinetics of Breakable Filament Assembly”. Science. 326 (5959): 1533—1537. Bibcode:2009Sci...326.1533K. DOI:10.1126/science.1178250. PMID 20007899.
- ↑ Masel J, Jansen VAA (2000). “Designing drugs to stop the formation of prions and other amyloids”. Biophysical Chemistry. 88 (1—3): 47—59. DOI:10.1016/S0301-4622(00)00197-6. PMID 11152275.
- ↑ Abbott A. (2010-01-24). “Healthy prions protect nerves”. Nature. DOI:10.1038/news.2010.29.
- ↑ Shorter J, Lindquist S (June 2005). “Prions as adaptive conduits of memory and inheritance”. Nature Reviews. Genetics. 6 (6): 435—50. DOI:10.1038/nrg1616. PMID 15931169. Используется устаревший параметр
|month=(справка) - ↑ Maglio LE, Perez MF, Martins VR, Brentani RR, Ramirez OA (2004). “Hippocampal synaptic plasticity in mice devoid of cellular prion protein”. Brain Research. Molecular Brain Research. 131 (1—2): 58—64. DOI:10.1016/j.molbrainres.2004.08.004. PMID 15530652.
- ↑ Caiati MD, Safiulina VF, Fattorini G, Sivakumaran S, Legname G, Cherubini E. (2013). “PrPC Controls via Protein Kinase A the Direction of Synaptic Plasticity in the Immature Hippocampus”. The Journal of Neuroscience. 33 (7): 2973—83. DOI:10.1523/JNEUROSCI.4149-12.2013. PMID 23407955.
- ↑ Zhang CC, Steele AD, Lindquist S, Lodish HF (2006). “Prion protein is expressed on long-term repopulating hematopoietic stem cells and is important for their self-renewal”. Proceedings of the National Academy of Sciences of the United States of America. 103 (7): 2184—9. Bibcode:2006PNAS..103.2184Z. DOI:10.1073/pnas.0510577103. PMC 1413720. PMID 16467153.
- 1 2 Baker & Ridley. Prion Disease. — New Jersey : Humana Press, 1996. — ISBN 0-89603-342-2.
- ↑ Supattapone (2010). “What makes a prion infectious?”. Science. 327 (5969): 1091—2. DOI:10.1126/science.1187790. PMID 20185716.
- 1 2 Deleault NR, Harris BT, Rees JR, Supattapone S (2007). “Formation of native prions from minimal components in vitro”. Proceedings of the National Academy of Sciences of the United States of America. 104 (23): 9741—6. Bibcode:2007PNAS..104.9741D. DOI:10.1073/pnas.0702662104. PMC 1887554. PMID 17535913.
- ↑ Geoghegan JC, Valdes PA, Orem NR; et al. (2007). “Selective incorporation of polyanionic molecules into hamster prions”. The Journal of Biological Chemistry. 282 (50): 36341—53. DOI:10.1074/jbc.M704447200. PMC 3091164. PMID 17940287.
- 1 2 Wang F, Wang X, Yuan CG, Ma J (2010). “Generating a prion with bacterially expressed recombinant prion protein”. Science. 327 (5969): 1132—5. Bibcode:2010Sci...327.1132W. DOI:10.1126/science.1183748. PMC 2893558. PMID 20110469.
- ↑ Legname G, Baskakov IV, Nguyen HO; et al. (2004). “Synthetic mammalian prions”. Science. 305 (5684): 673—6. Bibcode:2004Sci...305..673L. DOI:10.1126/science.1100195. PMID 15286374.
- ↑ Makarava N, Kovacs GG, Bocharova O; et al. (2010). “Recombinant prion protein induces a new transmissible prion disease in wild-type animals”. Acta Neuropathologica. 119 (2): 177—87. DOI:10.1007/s00401-009-0633-x. PMC 2808531. PMID 20052481.
- ↑ Deleault NR, Piro JR, Walsh DJ; et al. (May 2012). “Isolation of phosphatidylethanolamine as a solitary cofactor for prion formation in the absence of nucleic acids”. Proc. Natl. Acad. Sci. U.S.A. 109 (22): 8546—51. DOI:10.1073/pnas.1204498109. PMID 22586108. Используется устаревший параметр
|month=(справка) - ↑ Deleault NR, Walsh DJ, Piro JR; et al. (July 2012). “Cofactor molecules maintain infectious conformation and restrict strain properties in purified prions”. Proc. Natl. Acad. Sci. U.S.A. 109 (28): E1938—46. DOI:10.1073/pnas.1206999109. PMID 22711839. Используется устаревший параметр
|month=(справка) - ↑ Manuelidis L (March 2007). “A 25 nm virion is the likely cause of transmissible spongiform encephalopathies”. Journal of Cellular Biochemistry. 100 (4): 897—915. DOI:10.1002/jcb.21090. PMID 17044041. Используется устаревший параметр
|month=(справка) - ↑ Pathogenic Virus Found in Mad Cow Cells, Yale (2 февраля 2007). Проверено 28 февраля 2010.
- 1 2 Manuelidis L, Yu ZX, Barquero N, Banquero N, Mullins B (2007). “Cells infected with scrapie and Creutzfeldt-Jakob disease agents produce intracellular 25-nm virus-like particles”. Proceedings of the National Academy of Sciences of the United States of America. 104 (6): 1965—70. Bibcode:2007PNAS..104.1965M. DOI:10.1073/pnas.0610999104. PMC 1794316. PMID 17267596.
- ↑ Castilla J, Saá P, Hetz C, Soto C (2005). “In vitro generation of infectious scrapie prions”. Cell. 121 (2): 195—206. DOI:10.1016/j.cell.2005.02.011. PMID 15851027.
- 1 2 3 4 5 6 7 8 9 90. Prions. ICTVdB Index of Viruses. U.S. National Institutes of Health website (14 февраля 2002). Проверено 28 февраля 2010.
- ↑ Hussein MF, Al-Mufarrej SI (2004). “Prion Diseases: A Review; II. Prion Diseases in Man and Animals” (PDF). Scientific Journal of King Faisal University (Basic and Applied Sciences). 5 (2): 139. Проверено 2010-02-28.
- ↑ BSE proteins may cause fatal insomnia., BBC News (28 мая 1999). Проверено 28 февраля 2010.
- ↑ Robbins pathologic basis of disease / Robbins SL, Cotran RS, Kumar V, Collins T. — Philadelphia : Saunders, 1999. — ISBN 0-7216-7335-X.
- ↑ Belay ED (1999). “Transmissible spongiform encephalopathies in humans”. Annual Review of Microbiology. 53: 283—314. DOI:10.1146/annurev.micro.53.1.283. PMID 10547693.
- ↑ Prion Diseases. US Centers for Disease Control (26 января 2006). Проверено 28 февраля 2010. Архивировано 16 июня 2013 года.
- ↑ Gilch S, Winklhofer KF, Groschup MH; et al. (August 2001). “Intracellular re-routing of prion protein prevents propagation of PrP(Sc) and delays onset of prion disease”. The EMBO Journal. 20 (15): 3957—66. DOI:10.1093/emboj/20.15.3957. PMC 149175. PMID 11483499. Используется устаревший параметр
|month=(справка) - ↑ New York University Medical Center and School of Medicine. Active Vaccine Prevents Mice From Developing Prion Disease. Science Daily (14 мая 2005). Проверено 28 февраля 2010. Архивировано 16 июня 2013 года.
- ↑ Weiss, Rick. Scientists Announce Mad Cow Breakthrough., The Washington Post (1 января 2007). Проверено 28 февраля 2010. «Scientists said yesterday that they have used genetic engineering techniques to produce the first cattle that may be biologically incapable of getting mad cow disease.».
- ↑ Büeler H, Aguzzi A, Sailer A; et al. (1993). “Mice devoid of PrP are resistant to scrapie”. Cell. 73 (7): 1339—47. DOI:10.1016/0092-8674(93)90360-3. PMID 8100741.
- ↑ Collinge J (2001). “Prion diseases of humans and animals: their causes and molecular basis”. Annual Review of Neuroscience. 24: 519—50. DOI:10.1146/annurev.neuro.24.1.519. PMID 11283320.
- ↑ Ironside JW (2006). “Variant Creutzfeldt-Jakob disease: risk of transmission by blood transfusion and blood therapies”. Haemophilia : the Official Journal of the World Federation of Hemophilia. 12 Suppl 1: 8—15, discussion 26–8. DOI:10.1111/j.1365-2516.2006.01195.x. PMID 16445812.
- ↑ Groschup MH, Kretzschmar HA, eds. (2001). “Prion Diseases Diagnosis and Pathogeneis”. Archives of Virology. New York: Springer. Suppl 16.
- ↑ Geissen M, Krasemann S, Matschke J, Glatzel M (2007). “Understanding the natural variability of prion diseases”. Vaccine. 25 (30): 5631—6. DOI:10.1016/j.vaccine.2007.02.041. PMID 17391814.
- 1 2 Goldmann W (2008). “PrP genetics in ruminant transmissible spongiform encephalopathies”. Veterinary Research. 39 (4): 30. DOI:10.1051/vetres:2008010. PMID 18284908.
- ↑ Prion Clinic: Prion disease.
- ↑ Prion Clinic: Sporadic Prion Disease.
- ↑ Oesch B, Westaway D, Wälchli M; et al. (1985). “A cellular gene encodes scrapie PrP 27–30 protein”. Cell. 40 (4): 735—46. DOI:10.1016/0092-8674(85)90333-2. PMID 2859120.
- ↑ Johnson CJ, Pedersen JA, Chappell RJ, McKenzie D, Aiken JM (2007). “Oral transmissibility of prion disease is enhanced by binding to soil particles”. PLoS Pathogens. 3 (7): e93. DOI:10.1371/journal.ppat.0030093. PMC 1904474. PMID 17616973.
- ↑ Tamgüney, Gültekin; Miller, Michael W., Wolfe, Lisa L., Sirochman, Tracey M., Glidden, David V., Palmer, Christina, Lemus, Azucena, DeArmond, Stephen J., Prusiner, Stanley B. (9 September 2009). “Asymptomatic deer excrete infectious prions in faeces”. Nature. 461 (7263): 529—532. Bibcode:2009Natur.461..529T. DOI:10.1038/nature08289. PMC 3186440. PMID 19741608. Используется устаревший параметр
|coauthors=(справка) - ↑ MacKenzie, Debora. Prion disease can spread through air, New Science Publications (13 January 2011). Проверено 3 апреля 2011.
- ↑ Dorsselaer, Alain Van. Detection of Prion Protein in Urine-Derived Injectable Fertility Products by a Targeted Proteomic Approach, Public Library of Science (10 February 2011), стр. e17815. Проверено 3 апреля 2011.
- ↑ Qin K, O'Donnell M, Zhao RY (August 2006). “Doppel: more rival than double to prion”. Neuroscience. 141 (1): 1—8. DOI:10.1016/j.neuroscience.2006.04.057. PMID 16781817. Используется устаревший параметр
|month=(справка) - ↑ Race RE, Raymond GJ (2004). “Inactivation of transmissible spongiform encephalopathy (prion) agents by environ LpH”. Journal of Virology. 78 (4): 2164—5. DOI:10.1128/JVI.78.4.2164-2165.2004. PMC 369477. PMID 14747583.
- ↑ Collins SJ, Lawson VA, Masters CL (2004). “Transmissible spongiform encephalopathies”. Lancet. 363 (9402): 51—61. DOI:10.1016/S0140-6736(03)15171-9. PMID 14723996.
- ↑ Brown P, Rau EH, Johnson BK, Bacote AE, Gibbs CJ, Gajdusek DC (2000). “New studies on the heat resistance of hamster-adapted scrapie agent: threshold survival after ashing at 600 degrees C suggests an inorganic template of replication”. Proceedings of the National Academy of Sciences of the United States of America. 97 (7): 3418—21. Bibcode:2000PNAS...97.3418B. DOI:10.1073/pnas.050566797. PMC 16254. PMID 10716712.
- ↑ Ozone Sterilization. UK Health Protection Agency (14 апреля 2005). Проверено 28 февраля 2010. Архивировано 22 мая 2008 года.
- ↑ Weissmann C, Enari M, Klöhn PC, Rossi D, Flechsig E (2002). “Transmission of prions”. Proceedings of the National Academy of Sciences of the United States of America. 99 Suppl 4 (90004): 16378—83. Bibcode:2002PNAS...9916378W. DOI:10.1073/pnas.172403799. PMC 139897. PMID 12181490.
- ↑ Singh N et al. Prion Protein and Metal Interaction: Physiological and Pathological Implications // The Prion Protein. — Savanna Press, 2010. — ISBN 978-0-9543335-2-2.
- ↑ Kuwata K, Nishida N, Matsumoto T; et al. (2007). “Hot spots in prion protein for pathogenic conversion”. Proceedings of the National Academy of Sciences of the United States of America. 104 (29): 11921—6. Bibcode:2007PNAS..10411921K. DOI:10.1073/pnas.0702671104. PMC 1924567. PMID 17616582.
- ↑ Daryl Rhys Jones, William Alexander Taylor, Clive Bate, Monique David, Mourad Tayebi. A Camelid Anti-PrP Antibody Abrogates PrPSc Replication in Prion-Permissive Neuroblastoma Cell Lines // PLoS ONE. — 2010. — № 5(3). — DOI:10.1371/journal.pone.0009804.
- ↑ Brown, P. Ultra-high-pressure inactivation of prion infectivity in processed meat: A practical method to prevent human infection // Proceedings of the National Academy of Sciences. — 2003. — № 100(10). — P. 6093—6097. — DOI:10.1073/pnas.1031826100.
- ↑ Johnson, Christopher; Bennett; Biro; Duque-Velasquez; Rodriguez; Bessen; Rocke; Bartz; James P. Bennett, Steven M. Biro, Juan Camilo Duque-Velasquez, Cynthia M. Rodriguez, Richard A. Bessen, Tonie E. Rocke (17th). Bartz, Jason C, ed. “Degradation of the Disease-Associated Prion Protein by a Serine Protease from Lichens”. PLoS ONE. 6 (5): 9836. Bibcode:2011PLoSO...6E9836J. DOI:10.1371/journal.pone.0019836. Используется устаревший параметр
|coauthors=(справка); Проверьте дату в|date=, |year= / |date= mismatch(справка на английском) - ↑ Yam, Philip Natural Born Prion Killers: Lichens Degrade "Mad Cow" Related Brain Pathogen. Scientific American. Проверено 18 июня 2013. Архивировано 19 июня 2013 года.
- ↑ “Detecting Prions in Blood” (PDF). Microbiology Today: 195. August 2010. Архивировано из оригинала (PDF) 2011-10-01. Проверено 2011-08-21. Используется устаревший параметр
|deadlink=(справка); Некорректное значение|dead-url=404(справка) - ↑ SOFIA: An Assay Platform for Ultrasensitive Detection of PrPSc in Brain and Blood (недоступная ссылка). SUNY Downstate Medical Center. Проверено 19 августа 2011. Архивировано 9 ноября 2011 года.
- ↑ Scripps Research Institute Scientists Identify First Potentially Effective Therapy for Human Prion Disease; Unique drug screening approach for prion diseases identifies tacrolimus and astemizole as antiprion agents / PNAS April 23, 2013 vol. 110 no. 17
- ↑ Dong J, Bloom JD, Goncharov V; et al. (2007). “Probing the role of PrP repeats in conformational conversion and amyloid assembly of chimeric yeast prions”. The Journal of Biological Chemistry. 282 (47): 34204—12. DOI:10.1074/jbc.M704952200. PMC 2262835. PMID 17893150.
- ↑ Halfmann R, Alberti S, Lindquist S (2010). “Prions, protein homeostasis, and phenotypic diversity”. Trends in Cell Biology. 20 (3): 125—33. DOI:10.1016/j.tcb.2009.12.003. PMC 2846750. PMID 20071174.
- ↑ Galkin AP, Mironova LN, Zhuravleva GA, Inge-Vechtomov SG. (2006). “Yeast prions, mammalian amyloidoses, and the problem of proteomic networks”. Genetica. 42 (11): 1558. PMID 17163073.
- ↑ Nemecek, J; Nakayashiki, T, Wickner, RB (2011 Jun 14). “Retraction for Nemecek et al.: A prion of yeast metacaspase homolog (Mca1p) detected by a genetic screen”. Proceedings of the National Academy of Sciences of the United States of America. 108 (24): 10022. DOI:10.1073/pnas.1107490108. PMC 3116407. PMID 21628591. Используется устаревший параметр
|coauthors=(справка); Проверьте дату в|date=(справка на английском) - ↑ Rogoza T, Goginashvili A, Rodionova S, Ivanov M, Viktorovskaya O, Rubel A, Volkov K, Mironova L. (2010). “Non-Mendelian determinant [ISP+] in yeast is a nuclear-residing prion form of the global transcriptional regulator Sfp1.”. Proc. Natl. Acad. Sci. U.S.A. 107 (23): 10573—7. DOI:10.1073/pnas.1005949107. PMC 2890785. PMID 20498075.
- ↑ Genjiro Suzuki, Naoyuki Shimazu, Motomasa Tanaka (2012). “A Yeast Prion, Mod5, Promotes Acquired Drug Resistance and Cell Survival Under Environmental Stress”. Science. 336 (6079): 355—359. DOI:10.1126/science.1219491.
Литература
| Прион в Викисловаре | |
| Прион на Викискладе |
- И. С. Шкундина, М. Д. Тер-Аванесян. Прионы. Успехи биологической химии, т. 46, 2006 (обзор)
- Григорьев В. Б. Прионные болезни человека и животных // Вопросы вирусологии. — 2004. — Т. 49, № 5. — С. 4—12.
- Покровский В. И., Киселёв О. И., Черкасский Б. Л. Прионы и прионные болезни. — РАМН, 2004. — 384 с. — ISBN 5-7901-0038-4.
- S. B. Prusiner. Prion biology and diseases. — N. Y.: Cold Spring Harbor, 1999. — ISBN 0-87969-547-1.
- Инге-Вечтомов С. Г. Генетика с основами селекции. — СПб.: Издательство Н-Л, 2010. — 718 с. — ISBN 987-5-94869-105-3.
- Список русскоязычной литературы по теме «Прионы и прионные болезни»
Ссылки
На английском языке
- Mad Cow Disease Информация о коровьем бешенстве, Center for Global Food Issues.
- Madcowering A BSE-TSE blog.
- The Pathological Protein — Mad Cow, Chronic Wasting, and Other Deadly Prion Diseases (2003, updated online 2005). Philip Yam, Scientific American magazine writer and News Editor.
- Прионные заболевания (2003). Dr. Sean Heaphy, Leicester University.
- Prion Diseases and the BSE Crisis (1997). Статья Stanley Prusiner — первооткрывателя прионов, из Science magazine.
- Britannica Nobel: Прион, 1997
- ICTVdb 90.001.0.01. Mammalian Prions
- Сайт о болезни коровьего бешенства Mad Cow Disease
- News & Views on Mad Cow Disease, Mad Deer Disease, Chronic Wasting Disease, and Bovine Spongiform Encephalopathy
- Biography of Dr Prusiner
- Science Daily статья о вакцине против прионных заболеваний
- Science Daily article on transmission of prions through soil
- Обзор по прионам из Science Creative Quarterly
- Prion disease animation
На русском языке
- Прионы — новый класс возбудителей инфекционных заболеваний, В. А. Зуев, НИИ эпидемиологии и микробиологии им. Н. Ф. Гамалеи РАМН, Москва // АНТИБИОТИКИ И ХИМИОТЕРАПИЯ, 1999-N10, стр. 33-38.
- Патогенез и патологоанатомическая картина прионных болезней
- Прионы // Успехи биологической химии, т. 46, 2006, с. 3-423
- С. Э. Шноль, Белки Прионы (видеолекция) // Univertv.ru и МГУ, 27.02.2009
- Пирютко, Юрий. Прионы: опасные и удивительные. // Сайт Biomolecula.ru (27.09.2017). Проверено 26 марта 2018.
- Балахонова, Вероника. Прионы: исследования таинственных молекул продолжаются. // Сайт Biomolecula.ru (3.11.2012). Проверено 26 марта 2018.
- Паевский, Алексей. Разоблачитель белков-убийц. // Сайт Biomolecula.ru (26.04.2015). Проверено 26 марта 2018.
- Чугунов, Антон. Идентифицированы белки, «слипающиеся» при болезни Гентингтона. // Сайт Biomolecula.ru (14.05.2007). Проверено 26 марта 2018.
- Дергалёв, Александр. Прионные и неприонные амилоиды: определяет ли конформация разницу в инфекционности?. // Сайт Biomolecula.ru (25.11.2015). Проверено 26 марта 2018.
- Якупова, Эльмира. Агрегация белков: смерть или выживание?. // Сайт Biomolecula.ru (25.09.2017). Проверено 26 марта 2018.
- Кондратенко, Юлия. Мутация, защищающая от всех известных прионных болезней. // Сайт Biomolecula.ru (9.07.2015). Проверено 26 марта 2018.
Эта статья входит в число хороших статей русскоязычного раздела Википедии. |
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .