Карбонилы металлов — координационные комплексы переходных металлов с монооксидом углерода в качестве лиганда. Многие карбонилы металлов очень летучи. Находят применение в органическом синтезе, в качестве катализаторов (или прекурсоров катализаторов) для гомогенного катализа, например, при гидроформилировании или реакции Реппе. Карбонилы многих металлов, например, карбонил никеля, используются в процессе Монда для получения высокочистых металлов. В металлоорганической химии карбонилы металлов используются как прекурсоры для получения других металлоорганических комплексов. Карбонилы металлов ядовиты. При всасывании через неповрежденную кожу, вдыхании пыли или аэрозолей карбонилов, проглатывании, токсическое действие реализуется, в частности, из-за способности карбонилов карбонилировать гемоглобин с образованием карбоксигемоглобина, неспособного связывать О2[1].
История

Первые эксперименты по взаимодействию монооксида углерода с металлами были проведены Юстусом фон Либихом в 1834 году. Пропуская угарный газ над расплавленным калием он получил вещество, имеющее эмпирическую формулу KCO, которое он назвал Kohlenoxidkalium[2]. Позднее было показано, что соединение было не карбонилом металла, а калиевой солью гексагидроксибензола и калиевой солью дигидроксиацетилена[3].

Синтез первого истинного гетеролептического карбонильного комплекса металла был выполнен Полем Рене Шютценбергером в 1868. Пропусканием хлора и окиси углерода над платиновой чернью он получил дикарбонилдихлорплатину Pt(CO)2Cl2[4][5].
Людвиг Монд, один из основателей крупной химической компании Imperial Chemical Industries (ICI), исследовал в 1890-х годах вместе с Карлом Лангером (Carl Langer) и Фридрихом Квинке (Friedrich Quincke) различные процессы регенерации хлора, который расходовался в Солвэй-процессе (англ. Solvay process), с помощью металлического никеля, его оксида и солей[3]. В рамках своих экспериментов группа обрабатывала никель оксидом углерода, и было обнаружено, что образующийся газ окрашивал пламя бунзеновской горелки в зеленовато-желтый цвет, а при нагревании в стеклянной трубке образовывал никелевое зеркало. Газ может быть сконденсирован в бесцветную, прозрачную жидкость, с температурой кипения 43°С. Таким образом, Монд и его коллеги обнаружили первый чистый, гомолептический карбонил металла — тетракарбонил никеля (Ni(CO)4)[6]. Необычайно высокая летучесть соединения металла (тетракарбонила никеля) была отмечена фразой лорда Кельвина о том, что Монд «дал металлам крылья»[7].
В следующем году Монд и Марселен Бертло независимо открыли пентакарбонил железа, который производится по аналогичной методике, что и тетракарбонил никеля. Монд оценил экономический потенциал нового класса соединений, которые он коммерчески применил в процессе, позднее названном процессом Монда, и финансировал дополнительные исследования родственных соединений. Генрих Гиртц (Heinrich Hirtz) и его коллега М. Дальтон Ковап (M. Dalton Cowap) синтезировали карбонилы кобальта, молибдена, рутения, и впервые получили нонакарбонилдижелезо[8][9].
В 1906 году Джеймс Дьюар и Г. О. Джонс смогли определить структуру нонакарбонилдижелеза, которое образуется из пентакарбонила железа под действием солнечного света[10]. После кончины Монда в 1909 году, химия карбонилов металлов в течение нескольких лет пребывала в забвении. В 1924 году компания BASF начала промышленное производство пентакарбонила железа по методу, который был разработан Алвином Митташем. Пентакарбонил железа использовался для производства железа высокой чистоты, так называемого карбонильного железа, и железнооксидного пигмента — охры[11]. В 1927, А. Жоб и А. Кассаль получили гексакарбонила хрома и гексакарбонила вольфрама, новых гомолептических карбонилов металлов[12].
Уолтер Хибер несколько лет после 1928 играл решающую роль в развитии химии карбонилов металлов. Он проводил систематические исследования и открыл, в частности, основную реакцию Хибера (англ. Hieber base reaction[13]).
- Fe(CO)5 + OH- → H[Fe(CO)4]- + CO32- + H2O
- OH- → H[Fe(CO)4]- + CO32- + H2O
А в 1931 году получил и первый нейтральный гидрид карбонила: Fe(CO)4H2[12]. Это был первый известный способ синтеза гидридов карбонилов металлов и новый синтетический путь к некоторым неизвестным в то время карбонилам, например, декакарбонилдирению[14]. Так же им были открыты некоторые важные синтетические реакции карбонилов:[12]
- Fe(CO)5 + NH2CH2CH2NH2 → (NH2CH2CH2NH2)Fe(CO)3 + 2CO
- Fe(CO)5 + X2 → Fe(CO)4X2 + CO
Хибер, который с 1934 года был директором Института неорганической химии Технического Университета Мюнхена, опубликовал за четыре десятилетия 249 статей на тему химии карбонилов металлов[3].

(Ныне Институт угля имени Макса-Планка)
В 1935 году Л. Полинг предложил описание химической связи M-CO в на основе метода валентных связей[12].
В 1938 году О. Рёлен (O. Roelen) открыл реакцию гидроформилирования (оксо-синтез), позволяющую получить альдегиды взаимодействием ненасыщенных соединений с СО и Н2 в присутствии катализатора — карбонила металла VIII группы, чаще Co или Rh, которые образуют в реакционной среде активные гидриды состава H[M(CO)4][12]. В 1930-е годы Вольтер Реппе (англ. Walter Reppe), промышленный химик, а позже член правления компании BASF, открыл ряд гомогенных каталитических процессов, например, гидрокарбокислирование, в котором олефины или алкины вступают в реакцию с монооксидом углерода и водой с образованием ненасыщенных кислот и их производных[3]. В этих реакциях карбонилы, например никеля или кобальта, действуют как катализаторы[15]. Реппе также открыл циклотримеризацию и тетрамеризацию ацетилена и его производных в бензол и производные бензола, используя карбонилы металлов в качестве катализаторов. Компания BASF построила в 1960-е годы производственные мощности для получения акриловой кислоты по процессу Реппе, который только в 1996 году был заменен на более современный метод, основанный на каталитическом окислении пропилена.
В 1963 году Л. Васка открыл комплекс Васка (англ. Vaska’s complex): транс-IrCl(CO)(PPh3)2, способный обратимо связывать кислород[12].
Представители многих новых классов металлоорганических соединений были получены на основе карбонилов. В 1964 году на основе карбонила вольфрама Э. О. Фишером был получен первый карбеновый комплекс (OC)5W=C(OMe)Me, а в 1975 году им же был получен первый карбиновый комплекс I(OC)4Gr≡CR. В 1965 Р. Петтитом (R. Pettit) на основе пентакарбонила железа был получен первый комплекс антиароматического циклобутадиена (C4H4Fe(CO)3). В 1995 году А. Х. Зевайл (англ. Ahmed Zewail) исследовал разрыв связей M-M и M-CO в молекуле карбонила марганца в фемтосекундном масштабе времени (10−15 с) при помощи пульсирующего лазера, за что удостоен Нобелевской премии по химии 1999 года[16].


В 1981 году Роалд Хоффман был удостоен Нобелевской премии по химии за разработку полуэмпирической концепции изолобальной аналогии, основанной на теории молекулярных орбиталей. Она дала возможность исходя из общих представлений обсуждать геометрию и реакционную способность молекул и комплексов, возможность обдуманно подойти к разработке (дизайну) новых комплексов. Концепция описывает металл-карбонильные фрагменты M(CO)n как части октаэдрических «строительных блоков» по аналогии с тетраэдрическими CH3-, CH2- или CH- фрагментами в органической химии. Например, декакарбонилдимарганец, с точки зрения изолобальной аналогии, формируется из двух фрагментов d7Mn(CO)5, которые изолобальны метильному радикалу CH3•. Аналогично тому, как метильные радикалы объединяются формируя этан, карбонил-марганцевые фрагменты могут объединиться в декакарбонилдимарганец. Однако само существование изолобально-аналогичных фрагментов не означает, что желаемые структуры могут быть синтезированы. В своей Нобелевской лекции Хоффман подчеркнул, что изолобальная аналогия является полезной, но очень простой моделью, и в некоторых случаях не приводит к успеху[17][18].
Экономическая выгода использования металл-катализируемого карбонилирования, например, в Реппе химии и гидроформилировании, привела к расширению сферы применения карбонилов и стимулирует их дальнейшее изучение. Кроме того, карбонильные соединения металлов были обнаружены в активных центрах трех природных ферментов[19].
Номенклатура и терминология
Номенклатура карбонилов металлов определяется зарядом комплекса, числом и типом центральных атомов, количеством и типом лигандов и видом их связывания (терминальный, мостиковый, тип мостикового связывания). Карбонилы встречаются в виде нейтральных комплексов, катионов или солеобразующих анионов карбонилметаллатов. Монооксид углерода в качестве лиганда может быть связан с одним атомом металла (терминальный тип связывания) или мостиковой связью с двумя или более атомами металла. Комплексы могут быть гомолептическим, то есть содержащими только CO лиганды (например, карбонил никеля (Ni(CO)4), но чаще карбонилы металлов являются гетеролептическим и содержат смесь лигандов. Моноядерные карбонилы содержат только один атом металла в качестве центрального атома. За исключением гексакарбонила ванадия, только металлы с четным координационным числом, такие как хром, железо, никель и их соседи по подгруппе, способны образовывать нейтральные одноядерные комплексы. Полиядерные карбонилы, которые содержат связь металл-металл, образуют металлы с нечетными координационным числом[20]. Комплексы, образованные несколькими различными металлами, но только с одним типом лигандов называются ‘’’изолептическими’’’[20].
Число СО-лигандов в комплексе записывается греческой цифрой за которой следует слово «карбонил». Монооксид углерода в карбонилах металлов может иметь различные моды связывания, которые отличаются гаптичностью и видом связывания. Гаптичность отражает число молекул монооксида углерода, непосредственно связанных с центральным атомом, и указывается буквенным префиксом вида ηn в названии комплекса. Верхний индекс n указывает число атомов лиганда, образующих связи с другими атомами комплекса. В случае моногапто координации, например, терминально связанного монооксида углерода, гаптичность равна 1 и, как правило, не отражается в названии. Если монооксид углерода в комплексе связан и через атом углерода и через атом кислорода, то комплекс будет называться дигаптокоординированным η2[21].
Карбонильный лиганд проявляет несколько мод связывания в димерах карбонилов металлов и кластерах. Наиболее распространенный тип связывания — мостиковый, когда СО-лиганд соединяет два атома металлов. Эта мода связывания наблюдается у многих общедоступных карбонилов: Co2(CO)8, Fe2(CO)9, Fe3(CO)12, и Co4(CO)12[1][22]. В некоторых высших кластерах CO-лиганд образует мостики между тремя или даже четырьмя атомами металлов, такие моды обозначаются μ3-CO и μ4-CO. Менее распространены моды связывания, в которых оба атома C и O связаны с атомами металла, например μ3-η2.
Структура карбонилов и механизм связывания


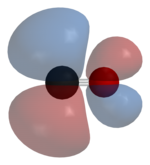
(разрыхляющая) молекулярная орбиталь
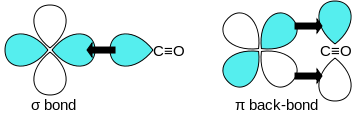
Монооксид углерода связывается с атомами переходных металлов по механизму обратного донирования (англ.: back-bonding, back-donation). Связывание состоит из трех компонентов, что приводит к образованию частично тройной связи. Сигма связь возникает при перекрывании несвязывающей sp-гибридизированной орбитали (с парой электронов) на атоме углерода с d-, s- и р-орбиталями атома металла. Две π-связи образуются при перекрывании заполненных d-орбиталей атома металла с двумя π-разрыхляющими орбиталями атома углерода в молекуле СО. Последний вид связывания требует наличия у атома металла d-электронов и его относительно низкой степени окисления (<+2), в противном случае обратное донирование не является выгодным. Как только электроны металла заполняют π*-разрыхляющие орбитали СО, они ослабляют связь углерод-кислород по сравнению со свободной молекулой монооксида углерода, в то время как связь металл-углерод усиливается. Множественный характер связи М-СО приводит к укорочению расстояния металл-углерод, которое часто меньше 1,8 Â, что примерно на 0,2 Â короче, чем связь металл-алкил. Описать приблизительный механизм связывания молекулы CO с атомом металла можно с использованием резонансных структур канонических форм молекул.

Строение некоторых карбонилов металлов
| Карбонил металла | Симметрия | Структура |
|---|---|---|
| Ni(CO)4 | Тетраэдр |  |
| Fe(CO)5 Ru(CO)5 Os(CO)5 |
Тригональная бипирамида |  |
| V(CO)6 Cr(CO)6 Mo(CO)6 W(CO)6 |
Октаэдр |  |
| Co2(CO)8 Rh2(CO)8 |
Незеркальная тригоналньая
бипирамида/мостиковый изомер |
 |
| Mn2(CO)10 Tc2(CO)10 Re2(CO)10 |
Незеркальный диоктаэдр |  |
| Fe2(CO)9 | Структура «Фонарь» |  |
| Ru3(CO)12 Os3(CO)12 Fe3(CO)12 |
Треугольный кластер |  |
| Ir4(CO)12 Co4(CO)12 |
Тетраэдрический кластер |  |
| Rh4(CO)12 | Тетраэдрический кластер |  |
Карбонилы Ti, Zr, Hf, Nb, Ta неизвестны, карбонилы Pd, Pt, Cu, Ag, Au в виде нейтральных бинарных комплексов зафиксированы только в низкотемпературной инертной матрице.(Ozin, 1976)[24]
Разделение циркония и гафния в виде карбонилов основывается на различии их температур кипения. В патентах не приводятся температуры кипения карбонилов, но отмечается, что карбонил циркония кипит при более низкой температуре, чем карбонил гафния, и отгоняется первым. Метод заключается в том, что тонко измельченный порошок циркония, содержащий гафний, помещают в реакционную камеру, снабженную мешалкой, вводят активированный уголь, а затем окись углерода в количестве, несколько превышающем стехиометрическое. При нагревании смеси под давлением 4—8 атм в интервале температур 300—800° С образуются жидкие карбонилы циркония и гафния, устойчивые при кипении и разрушающиеся при температурах на 50—100° С выше. [25]
Инфракрасная спектроскопия является чувствительным методом определения координированных карбонильных лигандов. Для соединений с мостиковыми СО лигандами, обозначается μ2-СО или просто μ-CO, полосы поглощения νCO обычно сдвинуты на 100—200 см-1 в сторону меньших энергий по сравнению с сигналами терминальных СО, приходящихся на область примерно 1800 см-1. Полосы «шапочных» (μ3) CO-лигандов проявляются при еще более низких энергиях. Типичные значения νCO для родиевых карбонильных кластеров:[26] Кроме симметричных видов связывания CO встречаются несимметричные или образованные за счет донирования с d-орбитали металла на π*-орбитали CO[27][28][29]. Усиление компонента π-связывания за счет обратного донирования от нескольких ядер металлов приводит к дальнейшему ослаблению связи С-О.
Физические свойства карбонилов
Большинство моноядерных карбонильных комплексов представляют собой бесцветные или бледно-желтые летучие жидкости или твердые вещества, способные воспламеняться и крайне токсичные[30]. Гексакарбонил ванадия, стабильный 17-электронный карбонил, образует сине-черные кристаллы[1]. Ди- и полиядерные карбонилы, как правило, имеют более насыщенную окраску. Трикарбонил железа (Fe3(CO)12) образует темно-зеленые кристаллы. Большинство кристаллических карбонилов металлов способно сублимироваться в вакууме, хотя этот процесс обычно сопровождается деградацией (отщеплением CO и образованием полиядерных комплексов). При интенсивном нагревании карбонилы разлагаются с выделением CO и мелкодисперсного металла. Карбонилы металлов растворимы в неполярных и полярных органических растворителях, таких как бензол, диэтиловый эфир, ацетон, ледяная уксусная кислота и четыреххлористый углерод. Некоторые соли катионных и анионных карбонилов металлов растворимы в воде и низших спиртах.
Физические свойства некоторых карбонилов металлов
| Карбонил металла | Цвет | tпл, °C | tкип, °C | Плотность (при 20 °C), г/см³ |
|---|---|---|---|---|
| V(CO)6 | зелёно-голубой | разлагается | — | |
| Cr(CO)6 | бесцветный | 150 | разлагается | 1,77 |
| Mn2(CO)10 | жёлтый | 157 | возгоняется | 1,75 |
| Fe(CO)5 | жёлтый | −20 | 103 | 1,455 |
| Fe2(CO)9 | оранжевый | разлагается | 2,85 | |
| Fe3(CO)12 | тёмно-зелёный | 165 | разлагается | |
| Со2(СО)8 | оранжево-красный | 51 | разлагается | 1,87 |
| Со4(СО)12 | чёрный | разлагается | ||
| Ni(CO)4 | бесцветный | −19,3 | 43 | 1,31 |
| Mo(CO)6 | бесцветный | 150 | разлагается | 1,96 |
| Tc2(CO)10 | бесцветный | 160 | ||
| Ru(CO)5 | бесцветный | −22 | ||
| Ru3(CO)12 | оранжевый | 155 | ||
| Rh2(CO)8 | оранжевый | 76 | ||
| Rh4(CO)12 | красный | |||
| W(CO)6 | бесцветный | 150 | разлагается | 2,65 |
| Re2(CO)10 | бесцветный | 177 | разлагается | 2,87 |
| Os(CO)5 | бесцветный | −15 | ||
| Os3(CO)12 | жёлтый | 224 | разлагается | |
| Ir2(CO)8 | зелёно-жёлтый | разлагается | — | |
| Ir4(CO)12 | жёлтый |
Анализ и характеризация

Важными аналитическими методами исследования карбонилов металлов являются инфракрасная спектроскопия и C13ЯМР-спектроскопия. Эти методы позволяют получить структурную информацию на двух различных временных масштабах. Инфракрасно-активные колебательные моды, такие как валентные колебания СО, характеризуются более высокой частотой по сравнению с внутримолекулярными процессами, в то время как ЯМР-переходы происходят при более низких частотах, которые оказываются сравнимыми со скоростью внутримолекулярных процессов обмена лигандов. Таким образом, ЯМР-спектры содержат информацию о «усредненной по времени структуре», в то время как ИК-спектры, в своем роде, мгновенные «снимоки»[31]. Примером различий во временных масштабах является то, что в инфракрасном спектре октакарбонила дикобальта (Co2(CO)8) наблюдается 13 полос поглощения νCO, что гораздо больше, чем ожидается для индивидуального соединения. Эта сложность спектра отражает наличие изомеров с мостиковыми CO-лигандами и без них. С13-ЯМР-спектр того же вещества содержит только один сигнал с химическим сдвигом 204 ppm. Это различие в спектрах означает, что изомеры карбонила быстро переходят друг в друга.
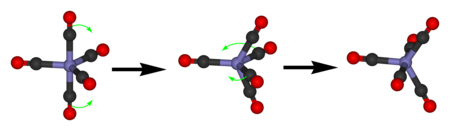
Пентакарбонил железа проявляет только один сигнал в С13-ЯМР спектре из-за быстрого обмена аксиального и экваториального СО-лигандов при псевдоротации Берри.
Инфракрасная спектроскопия карбонилов

Наиболее важным методом характеризации карбонилов металлов является инфракрасная спектроскопия[33]. Колебания C-O в газообразной свободной молекуле (обозначающиеся νCO) наблюдаются при 2143 см−1. Положение полос поглощения νCO карбонилов металлов связано с энергией ИК-активных колебательных мод, и коррелирует с прочностью связи углерод-кислород и обратно коррелирует с силой обратного донирования (англ. Backbonding) с d-орбиталей металла на π-орбитали углерода. π-основность металлического центра зависит от многих факторов: в изоэлектронном ряду от Ti к Fe (в нижней части этого раздела), гексакарбонилы проявляют уменьшение степени обратного донирования (π-backbonding) вслед за увеличением положительного заряда на металле. π-основные лиганды увеличивают плотность π-электронов на атоме металла, а также компенсируют снижение частоты, соответствующей νCO, вызванное обратным донированием. Электронный параметр Толмена использует фрагмент Ni(CO)3 для упорядочивания лигандов по их π-донирующей способности[34][35]. Число колебательных мод карбонильного комплекса металла может быть определено с помощью теории групп. Только те колебательные моды, которые преобразуются как оператор электрического дипольного момента, будут иметь ненулевое произведение групп и будут наблюдаются в ИК-спектре. Таким образом, можно предсказать число наблюдаемых ИК-переходов (но не их энергии)[36][37][38]. Например, CO-лиганды октаэдрических комплексов, например, Cr(CO)6, трансформируются как a1g, eg, и t1u, но только мода t1u (антисимметричное растяжение шапочных карбонильных лигандов) является ИК-активной. Таким образом, только одна полоса поглощения νCO наблюдается в ИК-спектрах октаэдрических гексакарбонилов металлов. Спектры комплексов более низкой симметрии являются более сложными. Например, в ИК-спектре Fe2(CO)9 проявляются полосы поглощения CO при 2082, 2019 и 1829 см−1. Перечень ИК-наблюдаемых колебательных мод для некоторых карбонилов металлов приведен в таблице, в литературных источниках доступны всеобъемлющие таблицы[33].
| Соединение | νCO (см−1) | Сдвиг C13-ЯМР | |
|---|---|---|---|
| CO | 2143 | 181 | |
| Ti(CO)6−2 | 1748 | ||
| V(CO)6−1 | 1859 | ||
| Cr(CO)6 | 2000 | 212 | |
| Mn(CO)6+ | 2100 | ||
| Fe(CO)62+ | 2204 | ||
| Fe(CO)5 | 2022, 2000 | 209 |
| Карбонил | νCO, µ1 (cm−1) | νCO, µ2 (cm−1) | νCO, µ3 (cm−1) |
|---|---|---|---|
| Rh2(CO)8 | 2060, 2084 | 1846, 1862 | |
| Rh4(CO)12 | 2044, 2070, 2074 | 1886 | |
| Rh6(CO)16 | 2045, 2075 | 1819 |
Спектроскопии ядерного магнитного резонанса
С13 ЯМР-спектроскопия является традиционным методом изучения карбонилов металлов. Для повышения чувствительности метода, комплексы нередко обогащают C13O. Типичный диапазон химических сдвигов для терминальных карбонильных лигандов составляет от 150 до 220 ppm, для мостиковых — от 230 до 280 ppm[1]. В спектрах C13 сигналы смещаются в сторону сильного поля с увеличением атомного номера центрального металла.
Спектроскопию ядерного магнитного резонанса можно использовать для экспериментального определения динамики комплекса[31]. Энергия активации процессов обменов лигандов может быть определена по температурной зависимости уширения линий в спектре[39].
Масс-спектрометрия
Масс-спектрометрия позволяет получить информацию о структуре и составе комплексов. Спектры поликарбонилов металлов обычно легко интерпретировать, поскольку доминирующим процессом фрагментации является потеря карбонильных лигандов (m/z = 28).
- M(CO)n+ → M(CO)n-1+ + CO
Ударная электронная ионизация является наиболее распространенным методом характеризации нейтральных карбонилов металлов. Нейтральный карбонил металла может быть преобразован в заряженный комплекс посредством химических превращений, что дает возможность использовать ионизацию электрораспылением (электроспрей), оборудование для которой широко распространены и доступны. Например, обработка карбонила металла алкоксидом (алкоголятом ЩМ) дает анионные металлкарбоксилаты (также называемые металлформиатами или карбонилметаллатами), которые можно анализировать с помощью ESI-MS:
- LnM(CO) + RO− → [LnM-C(=O)OR]−
Некоторые карбонилы металлов реагируют с азидами, что дает изоцианатные комплексы с выделением азота[40]. Степень фрагментации можно контролировать регулируя напряжение на конусе и/или температуру. ESI-MS позволяет определить молекулярную массу исходного комплекса, а также информацию о структурных перестройках, связанных с потерей карбонильных лигандов[41].
Распространенность в природе

Для свободного гема гемоглобина человека в растворе сродство к CO превышает сродство к O2 в 20 000 раз, что ставит под угрозу существование сложной жизни на Земле, однако белки гема — миоглобин и гемоглобин снижают селективность связывания, и отношение показателей селективности связывания CO к O2 составляет 25 к 200. Длительное время не удавалось установить причину этого эффекта. Например, для фрагмента Fe-C-O ранние рентгеноструктурные исследования показали неизвестное у карбонилов уголковое строение с углом 40-60˚. Лишь к концу XX века было установлено, что фрагмент практически линеен (с углом не более 7-9˚), причем линейная координация оказывается невыгодной из-за стерических затруднений, создаваемых белками окружения. Координированный O2, напротив, имеет уголковое строение, в котором терминальный атом кислорода образует стабилизирующую водородную связь с дальним гистидиновым остатком гема[43].
В исследованиях инфракрасного спектра Галактического Ядра в межзвездных пылевых облаках были обнаружены колебания CO, характерные для карбонилов железа[44]. Кластеры карбонилов железа также наблюдались посредством ИК-спектроскопии в хондритах Jiange H5. Были найдены четыре ИК-частоты растяжения, характерные для терминальных и мостиковых карбонильных лигандов[45].
В богатой кислородом атмосфере Земли карбонилы металлов окисляются до оксидов. Но возможность образования таких комплексов в восстановительной гидротермальной среде в пре-биотическом периоде истории и возможность их участия в качестве катализаторов в синтезе критических биохимических соединений, например, пировиноградной кислоты, является предметом дискуссий[46]. Следы карбонилов железа, никеля, вольфрама были найдены в газообразных эманациях осадков сточных вод муниципальных очистных сооружений[47].
Ферменты-гидрогеназы содержат молекулу СО, связанную с атомом железа. По-видимому, СО стабилизирует низкие степени окисления металла, что облегчает связывание водорода. Ферменты CO-дегидрогеназы и ацетил-КоА-синтазы также участвуют в биопревращениях СО[48]. Некоторые CO-содержащие комплексы задействуются при отравлении угарным газом и выполняют сигнальную роль[49].
Синтез карбонилов
Синтез карбонилов металлов является предметом интенсивных исследований металлорганической химии. С момента опубликования работ Монда (Mond), а затем Хибера (Hieber), было разработано множество методов синтеза как моноядерных карбонилов металлов, так и гомо- и гетерометаллических карбонильных кластеров[3].
Прямое взаимодействие металла с оксидом углерода
Тетракарбонил никеля и пентакарбонил железа могут быть получены согласно следующим уравнениям реакций при взаимодействии тонкодисперсного металла с оксидом углерода:[50]
- Ni + 4 CO → Ni(CO)4 (1 bar, 55 °C)
- Fe + 5 CO → Fe(CO)5 (100 bar, 175 °C)
Никель реагирует с монооксидом углерода уже при 80°С при атмосферном давлении, а тонко измельченное железо реагирует при температурах 150—200°С и давлении моноксида углерода от 50 до 200 Бар[11]. Карбонилы других металлов получают более сложным путём.
Восстановление солей металлов и их оксидов
Карбонилы некоторых металлов получают путём восстановления галогенидов металлов в присутствии моноокисида углерода под высоким давлением. Могут использоваться разнообразные восстановители, в том числе медь, алюминий, водород, а также алкилы металлов, например, триэтилалюминий. Показательным является образование гексакарбонила хрома из безводного хлорида хрома (III) в бензоле с алюминием в качестве восстанавливающего агента и хлоридом алюминия в качестве катализатора:[50]
- CrCl3 + Al + 6 CO → Cr(CO)6 + AlCl3
Использование алкилов металлов, например триэтилалюминия и диэтилцинка в качестве восстановителей приводит к окислительному сочетанию алкильных радикалов в димеры:
- WCl6 + 6 CO + 2 Al(C2H5)3 → W(CO)6 + 2 AlCl3 + 3 °C4H10
Соли вольфрама, молибдена, марганца и родия могут быть восстановлены с помощью литийалюминийгидрида. Гексакарбонилванадий получают используя натрий в качестве восстанавливающего агента в хелатирующих растворителях, например — диглиме[30].
- VCl3 + 4 Na + 6 CO 2 diglyme → Na(diglyme)2[V(CO)6] + 3 NaCl
- [V(CO)6]− + H+ → H[V(CO)6] → 1/2 H2 + V(CO)6
В водной среде соли никеля или кобальта могут быть восстановлены, например, с помощью дитионита натрия. В присутствии CO соли кобальта количественно превращаются в тетракарбонилкобальт-анион:[30]
- Co2+ + 1.5 S2O42− + 6 OH− + 4 CO → Co(CO)4− + 3 SO32− + 3 H2O
Некоторые карбонилы металлов получают используя CO в качестве восстановителя. Именно таким путём Хибер (англ. Hieber) и Фукс (англ. Fuchs) впервые получили декакарбонилдирений из оксида рения:[51]
- Re2O7 + 17 CO → Re2(CO)10 + 7 CO2
Если используются оксиды металлов, то, в качестве продукта реакции, образуется диоксид углерода. При восстановлении хлоридов металлов монооксидом углерода образуется фосген, как, например, при полученит хлорида карбонил-осмия из хлорида осмия[3]. CO также подходит для восстановления сульфидов металлов, тогда побочным продуктом является карбонилсульфид.
Фотолиз и термолиз
Фотолиз или термолиз моноядерных карбонилов приводит к образованию двух- и полядерных карбонилов, как, например, нонакарбонилдижелезо (Fe2(CO)9)[52][53]. При дальнейшем нагревании карбонил разлагается в конечном счете на свободный металл и монооксид углерода.
- 2 Fe(CO)5 → Fe2(CO)9 + CO
Термическое разложение додекакарбонила триосмия (Os3(CO)12) приводит к образованию многоядерных осмий-карбонильных кластеров, как, например, Os4(CO)13, Os6(CO)18 и даже Os8(CO)23[30].
Смешанно-лигандные карбонилы рутения, осмия, родия и иридия часто образуются в результате поглощения СО из растворителей, например диметилформамида (ДМФ) и 2-метоксиэтанола. Характерным является синтез комплекса Л. Васка (англ. Vaska’s Complex)) транс-IrCl(CO)(PPh3)2 в результате реакции хлорида иридия (III) с трифенилфосфином в кипящем ДМФ.
Метатезис солей
Реакция метатезиса солей, например, KCo(CO)4 с [Ru(CO)3Cl2]2, приводит к избирательному образованию смешанного карбонильного комплекса, в данном случае: RuCo2(CO)11[54].
- KCo(CO)4 + [Ru(CO)3Cl2]2 → 2 RuCo2(CO)11 + 4 KCl
Катионы карбонилов металлов и карбонилметаллаты
Синтез ионных карбонильных комплексов возможен посредством окисления или восстановления нейтральных комплексов. Анионные карбонилметаллаты металлов могут быть получены, например, путём восстановления биядерных комплексов натрием. Известным примером является натриевая соль тетракарбонилата железа (Na2Fe(CO)4, реагент Коллмана), который используется в органическом синтезе[55].
Катионные соли гексакарбонила марганца, технеция и рения могут быть получены из галогенидов соответствующих карбонилов под давлением монооксида углерода по реакции с кислотой Льюиса.
- Mn(CO)5Cl + AlCl3 + CO → Mn(CO)6+AlCl4−
Использованием сильных кислот удалось получить катионы карбонила золота, например [Au(CO)2]+, который используется в качестве катализатора для карбонилирования олефинов[56]. Катионные комплексы карбонила платины [Pt(CO)4]+ могут быть получены обработкой суперкислотами, например пентафторидом сурьмы.
Химические свойства карбонилов
Карбонилы металлов — важные прекурсоры в синтезе других металлоорганических комплексов и соединений. Основные реакции это реакции замещения карбонильного лиганда другими лигандами, реакции окисления и восстановления металлического центра и реакции карбонильного лиганда
Замещение CO
Замещение СО-лигандов другими донорными лигандами может быть индуцировано термически или фотохимически. Перечень лигандов-заместителей велик и включает в себя фосфины, цианиды (CN-), азот-содержащие донорные лиганды, и даже простые эфиры, особенно хелатирующие (диоксан, ТГФ). Эффективными лигандами являются и олефины (особенно диолефины), которые образуют синтетически значимые производные. Замещение в 18-электронных комплексах в целом соответствует диссоциативному механизму с образованием 16-электронного интермедиата.
Замещение идет по диссоциативному механизму:
- M(CO)n → M(CO)n-1 + CO
- M(CO) n-1 + L → M(CO)n-1L
Энергия диссоциации составляет 105 кДж моль −1 для карбонила никеля и 155 кДж −1 для гексакарбонила хрома[1].
Редко встречающееся замещение в 17-электронных комплексах протекает по ассоциативному механизму с 19-электронным интермедиатом:
- M(CO)n + L → M(CO)nL
- M(CO)nL → M(CO)n-1L + CO
Процесс замещения в 18-электронных комплексах иногда катализируется небольшим количеством окислителя посредством передачи электрона[57].
Восстановление
Карбонилы металлов вступают в реакцию с восстановителями, такими как металлический натрий или амальгама натрия, образуя карбонилметаллат-анионы:
- Mn2(CO)10 + 2 Na → 2 Na[Mn(CO)5]-
Пентакарбонил железа образует тетракарбонилферрат с потерей CO:
- Fe(CO)5 + 2 Na → Na2Fe(CO)4 + CO
Ртуть может встраиваться по связи металл-металл в некоторых полиядерных карбонилах металлов:
- Co2(CO)8 + Hg → (CO)4Co-Hg-Co(CO)4
Нуклеофильная атака по CO
Обычно CO-лиганд легко подвергается нуклеофильной атаке. Например, триметиламин оксид и калия бис-(триметилсилил)амид преобразуют СО-лиганд в CO2 и CN-, соответственно. В основной реакции Хибера (англ. Walter Hieber), гидроксид-ион атакует СО-лиганд с образованием металлокарбоксилата, с последующим выделением диоксида углерода и образованием гидрида металла или карбонилметаллата. Хорошо известным примером такого нуклеофильного присоединения является превращение пентакарбонила железа в H2Fe(CO)4:
- Fe(CO)5 + NaOH → Na[Fe(CO)4CO2H]
- Na[Fe(CO)4COOH] + NaOH → Na[HFe(CO)4] + NaHCO3
Протонирование гидридоаниона дает нейтральный тетракарбонил гидрид железа:
- Na[HFe(CO)4] + H+ → H2Fe(CO)4 + Na+
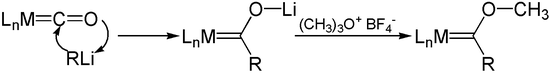
Добавление литийорганических реагентов к карбонилам металлов дает ацилметаллические карбонильные анионы (комплексы Фишера). О — алкилирование этих анионов, например, солями Меервейна, дает карбеновые комплексы переходных металлов (карбены Фишера).
С электрофилами
Несмотря на низкую формальную степень окисления, карбонилы металлов относительно инертны к действию многих электрофилов. Например, они устойчивы к действию алкилирующих агентов, слабых кислот, мягких окислителей. Большинство карбонилов металлов подвергается галогенированию. Пентакарбонил железа, например, образует карбонильные галогениды:
- Fe(CO)5 + X2 → Fe(CO)4X2 + CO
Галогены способны расщеплять связь металл-металл:
- Mn2(CO)10 + Cl2 → 2 Mn(CO)5Cl
Разнообразие карбонилов и их химические формы
Большинство металл-карбонильных комплексов содержит смесь лигандов. Например исторически значимый комплекс Васка (транс-IrCl(CO)(PPh3)2) и антидетонационный агент метилциклопентадиенилтрикарбонил марганца (CH3C5H4)Mn(CO)3). Исходными соединениями для многих смешанных комплексов служат бинарные карбонилы, то есть отвечающие формуле [Mx(CO)n]z, многие из которых коммерчески доступны. Молекулярная формула многих карбонилов металлов может быть выведена исходя из 18-электронного правила.
Электронейтральные бинарные карбонилы металлов
- Карбонилы элементов 4 группы с 4 валентными электронами редки, но замещенные производные Ti(CO)7 известны.
- Карбонилы элементов 5 группы с 5 валентными электронами подвержены стерическим эффектам, которые препятствуют образованию М-М связей, как, например, в V2(CO)12, который неизвестен, хотя 17-электронный V(CO)6 известен и устойчив.
- Карбонилы элементов 6 группы с 6 валентными электронами образуют 18-электронные карбонильные комплексы Cr(CO)6, Mo(CO)6, W(CO)6. В металлорганическом синтезе для элементов 6 группы (как и для 7 группы) известен «цис эффект», заключающийся в лабилизации СО в цис-положении.
- Карбонилы элементов 7 группы с 7 валентными электронами образуют димеры карбонилов: Mn2(CO)10, Tc2(CO)10, и Re2(CO)10 (7 + 1 + 5 × 2 = 18 электронов).
- Карбонилы элементов 8 группы с 8 валентными электронами образуют карбонилы металлов
Fe(CO)5, Ru(CO)5 и Os(CO)5 (8 + 5 × 2 = 18 электронов). Последние два неустойчивы и склонны к декарбонилированию с образованием Ru3(CO)12, и Os3(CO)12. Так же известны два других карбонила железа: Fe2(CO)9 и Fe3(CO)12.
- Карбонилы элементов 9 группы с 9 валентными электронами, как и ожидается, образуют димеры карбонилов вида M2(CO)8. На практике устойчивыми оказываются только производные октакарбониладикобальта, но для всех трех элементов 9 группы хорошо известны тетрамеры карбонилов: Co4(CO)12, додекакарбонил родия Rh4(CO)12, гексадекакарбонил родия Rh6(CO)16, и додекакарбонил иридия Ir4(CO)12 (9 + 3 + 3 × 2 = 18 электронов). В отличие от большинства 18-электронных карбонильных комплексов переходных металлов октакарбонилдикобальт Co2(CO)8 чувствителен к кислороду.
- Карбонилы элементов 10 группы с 10 валентными электронами образуют карбонилы вида Ni(CO)4 (10 + 4 × 2 = 18 электронов). Карбонилы Pd(CO)4 и Pt(CO)4 не являются стабильными.
Анионные биядерные карбонильные комплексы металлов
- Элементы 4 группы: дианионы карбонилов сходны с нейтральными производными карбонилов элементов 6 группы: [Ti(CO)6]2-[58].
- Элементы 5 группы: анионы сходны с нейтральными производными карбонилов элементов 6 группы: [Ti(CO)6]2-.
- Элементы 7 группы: моноанионы сходны с нейтральными производными карбонилов элементов 8 группы: [M(CO)5]- (M = Mn, Tc, Re).
- Элементы 8 группы: дианионы карбонилов сходны с нейтральными производными карбонилов элементов 10 группы: [M(CO)4]2- (M = Fe, Ru, Os). Конденсированные производные также известны.
- Элементы 9 группы: моноанионы карбонилов сходны с нейтральными производными карбонилов элементов 10 группы. Наиболее изученным является карбонил кобальта [Co(CO)4]-.
Также хорошо известны крупные анионные кластеры Ni, Pd и Pt.
Катионные карбонильные комплексы металлов
- Элементы 7 группы: монокатионы сходны с нейтральными производными карбонилов элементов 6 группы: [M(CO)6]+ (M = Mn, Tc, Re).
- Элементы 8 группы: бикатионы так же сходны с нейтральными производными карбонилов элементов 6 группы: [M(CO)6]2+ (M = Fe, Ru, Os)[59].
Гидриды карбонилов металлов
| Гидрид карбонила металла | pKa |
|---|---|
| HCo(CO)4 | «сильная» |
| HCo(CO)3(P(OPh)3) | 5.0 |
| HCo(CO)3(PPh3) | 7.0 |
| HMn(CO)5 | 7.1 |
| H2Fe(CO)4 | 4.4, 14 |
| [HCo(dmgH)2PBu3] | 10.5 |
Карбонилы металлов способны образовывать комплексы с отрицательными степенями окисления, как, например, анионы, описанные выше. Эти анионы могут быть протонированы с образованием соответствующих гидридов карбонильных комплексов металлов. Нейтральные гидриды карбонилов металлов обычно летучи и могут проявлять кислые свойства (псевдогалогены)[60].
Практическое применение

Карбонилы металлов используются в нескольких промышленных процессах. Возможно самым первым применением стало выделение и очистка никеля перегонкой его тетракарбонила (процесс Монда). Аналогично очень чистое порошковое железо получают термическим разложением пентакарбонила железа. Карбонил железа используется в частности для изготовления индукторов, красителей, диетических добавок[61], при производстве радиопоглощающих материалов для стелс-технологий[62] и для создания металлопокрытий термораспылением.
Карбонилы металлов — хорошие антидетонаторы моторного топлива, однако при их сгорании образуются трудноудаляемые оксиды. Некоторые карбонилы используются для получения абсолютно чистого оксида углерода (II).
Катализ
Карбонилы металлов используются в ряде промышленно важных реакций карбонилирования. В оксо (анг. oxo) процессе олефин, водород и монооксид углерода совместно взаимодействуют с катализатором (например, октакарбонилом дикобальта), образуя альдегиды. Например, в производстве масляного альдегида (бутираля):
- H2 + CO + CH3CH=CH2 → CH3CH2CH2CHO
Бутиральдегид преобразуется в промышленном масштабе в 2-этилгексанол, предшественник пластификаторов ПВХ, с помощью альдольной конденсации, с последующим гидрированием полученного гидроксиальдегида. Оксоальдегиды, полученные гидроформилированием, используются для крупномасштабного синтеза жирных спиртов, которые являются предшественниками моющих средств. Гидроформилирование является высокоэкономной реакцией, особенно если процесс протекает с высокой региоселективностью.
Другой важной реакцией, катализируемой карбонилами металлов, является гидрокарбоксилирование (реакция Реппе). Ниже приведен пример синтеза акриловой кислоты и сложных эфиров акриловой кислоты:
Также реакция циклизации ацетилена в циклооктатетраен осуществляется с использованием металл-карбонильных катализаторов:[63]
В процессах Монсанто (англ. Monsanto) и Кативы (англ. Cativa process), уксусную кислоту получают из метанола, моноокида углерода и воды с помощью родиевого и иридиевого карбонильного катализатора в присутствии йодоводорода. Родственные реакции карбонилирования дают уксусный ангидрид.
Медицина и лекарственные средства
CO-выделяющие молекулы (СО-ВМ; англ. CO-releasing molecules, CO-RMs) представляют собой карбонильные комплексы металлов, которые разрабатываются в качестве потенциальных CO-выделяющих препаратов. При низких концентрациях угарный газ функционирует как сосудорасширяющее и противовоспалительное средство. CO-ВМ задуманы как стратегический фармакологический метод транспорта и доставки контролируемых количеств CO к тканям и органам[64].
Гетеролигандные комплексы карбонилов
Многие карбонилы, как известно, образуют гомолептические и смешанные комплексы, которые являются производными или аналогичны карбонилам металлов.
Нитрозильные комплексы
Нитрозильные комплексы металлов, включающие молекулу NO в качестве лиганда, многочисленны, хотя гомолептические производные неизвестны. По сравнению с CO, NO является сильным акцептором, а изоцианиды лучшими донорами. Известные нитрозильные карбонилы включают CoNO(CO)3 и Fe(NO)2(CO)2[65]. Для нитрозильных комплексов так же известно два типа координации молекулы NO, в одном случае молекула линейна (резонансная структура NO+) и является донором трех электронов, в другом имеет уголковое строение (резонансная структура NO-) и является донором одного электрона, тогда как молекула CO всегда является двухэлектроным донором. Как и CO, молекулы NO могут быть как терминальными, так и мостиковыми лигандами[66]. Некоторые водорастворимые нитрозильные комплексы могут использоваться в качестве NO-содержащих лекарственных препаратов, например, при терапии солидных раковых опухолей[67].
Тиокарбонильные комплексы
Комплексы, содержащие CS (моносероуглерод), известны, но редки[68][69]. Редкость таких комплексов отчасти обусловлена очевидной нестабильностью исходного соединения — моносульфида углерода. По этой причине синтез тиокарбонильных комплексов требует более сложных путей, как, например, взаимодействие тетракарбонилферрата натрия с тиофосгеном:
- Na2Fe(CO)4 + CSCl2 → Fe(CO)4CS + 2 NaCl
Комплексы, включающие CSe и CTe очень редки.
Фосфиновые комплексы
Все карбонилы металлов вступают в реакцию замещения карбонильных лигандов фосфорорганическими лигандами. Например, комплексы состава Fe(CO)5-x(PR3)x известны для х = 1, 2 и 3. PF3 ведет себя аналогично, но примечателен способностью легко образовывать гомолептические аналоги биядерных карбонилов металлов. Например, летучие, устойчивые комплексы Fe(PF3)5 и Co2(PF3)8 представляют собой не содержащие CO аналоги Fe(CO)5 и Co2(CO)8 (не мостиковый изомер).
Изоцианидные комплексы
Изоцианиды также образуют обширные семейства смешанных комплексов с карбонилами металлов. Типичными изоцианидными лигандами являются метил- и трет-бутил изоцианид (Me3CNC). Особый случай представляет трифторметилизоцианид, нестабильные молекулы которого образуют устойчивые комплексы, физические и химические свойства которых весьма близко к поведению карбонилов металлов.
Токсикология
Все карбонилы являются ядовитыми веществами. Токсичность карбонилов металлов связана с токсичностью монооксида углерода и металла, и определяется летучестью и неустойчивостью комплексов. Попадание в организм происходит при вдыхании пыли или аэрозолей карбонилов, проглатывании жидких и твердых карбонилов, или при всасывании через кожу (ввиду хорошей растворимости карбонилов в жирах). Наибольший клинический опыт охватывает отравления карбонилом никеля и пентакарбонилом железа. Карбонил никеля считается одним из сильнейших ингаляционных ядов[70].
Вдыхание карбонила никеля вызывает острые неспецифические симптомы, сходные с отравлением угарным газом, в их числе тошнота, кашель, головные боли, лихорадка и головокружение. Через некоторое время появляются более тяжелые легочные симптомы — кашель, тахикардия, цианоз, или симптомы, связанные с желудочно-кишечным трактом. Кроме патологических изменений в легких, например, металлизации альвеол, наблюдаются повреждения мозга, печени, почек, надпочечников и селезенки. Отравление карбонилами металлов обычно требует длительного периода восстановления организма[71]. Хроническое воздействие при вдыхании низких концентраций карбонила никеля может вызвать неврологические симптомы, такие как бессонница, головные боли, головокружение и потеря памяти[71]. Карбонил никеля считается канцерогеном, но может пройти от 20 до 30 лет от начала воздействия до клинических проявлений рака[72].
Литература
- Эльшенбройх К. Металлоорганическая химия. — М.: БИНОМ. Лаборатория знаний. — 2011. С. 324 — ISBN 978-5-9963-0203-1.
Примечания
- 1 2 3 4 5 Elschenbroich, C. Organometallics. — Weinheim : Wiley-VCH, 2006. — ISBN 3-527-29390-6.
- ↑ Trout, W. E. Jr. (1937). “The Metal Carbonyls. I. History; II. Preparation”. Journal of Chemical Education. 14 (10): 453. Bibcode:1937JChEd..14..453T. DOI:10.1021/ed014p453.
- 1 2 3 4 5 6 Herrmann, W. A. (1988). “100 Jahre Metallcarbonyle. Eine Zufallsentdeckung macht Geschichte”. Chemie in unserer Zeit. 22 (4): 113—122. DOI:10.1002/ciuz.19880220402.
- ↑ Schützenberger, P. (1868). “Mémoires sur quelques réactions domnant lieu à la production de l'oxychlorure de carbone, et sur nouveau composé volatil de platine”. Bulletin de la Société Chimique de Paris. 10: 188—192.
- ↑ Эльшенбройх К. Металлоорганическая химия. — М.: БИНОМ. Лаборатория знаний. — 2011. С. 11 — ISBN 978-5-9963-0203-1.
- ↑ Mond, L.; Langer, C.; Quincke, F. (1890). “Action of Carbon Monoxide on Nickel”. Journal of the Chemical Society, Transactions. 57: 749—753. DOI:10.1039/CT8905700749.
- ↑ Gratzer, W. (2002). “Eureka and Euphorias: The Oxford Book of Scientific Anecdotes”. Oxford University Press. ISBN 0-19-280403-0. Параметр
|chapter=пропущен (справка на английском) - ↑ Mond, L.; Hirtz, H.; Cowap, M. D. (1908). “Note on a Volatile Compound of Cobalt with Carbon Monoxide”. Chemical News. 98: 165—166.
- ↑ Chemical Abstracts. 2: 3315. 1908.
|title=пусто или отсутствует (справка) - ↑ Dewar, J.; Jones, H. O. (1905). “The Physical and Chemical Properties of Iron Carbonyl” (pdf). Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 76 (513): 558—577. Bibcode:1905RSPSA..76..558D. DOI:10.1098/rspa.1905.0063.
- 1 2 Mittasch, A. (1928). “Über Eisencarbonyl und Carbonyleisen”. Angewandte Chemie. 41 (30): 827—833. DOI:10.1002/ange.19280413002.
- 1 2 3 4 5 6 Эльшенбройх К. Металлоорганическая химия. — М.: БИНОМ. Лаборатория знаний. — 2011. С. 12 — ISBN 978-5-9963-0203-1.
- ↑ Highly-Reduced Metal Carbonyls — Beck — 2003 — Angewandte Chemie International Edition in English — Wiley Online Library
- ↑ Basolo, F. From Coello to Inorganic Chemistry: A Lifetime of Reactions. — Springer, 2002. — P. 101. — ISBN 978-030-646774-5.
- ↑ Chemicals from Synthesis Gas: Catalytic Reactions of CO and H2 / Sheldon, R. A.. — Kluwer, 1983. — Vol. 2. — P. 106. — ISBN 978-9027714893.
- ↑ Эльшенбройх К. Металлоорганическая химия. — М.: БИНОМ. Лаборатория знаний. — 2011. С. 13 — ISBN 978-5-9963-0203-1.
- ↑ Hoffmann, R. Building Bridges between Inorganic and Organic Chemistry. Nobelprize.org (8 декабря 1981).
- ↑ Эльшенбройх К. Металлоорганическая химия. — М.: БИНОМ. Лаборатория знаний. — 2011. С. 14 — ISBN 978-5-9963-0203-1.
- ↑ Tard, C; Pickett, C. J. (2009). “Structural and Functional Analogues of the Active Sites of the [Fe]-, [NiFe]-, and [FeFe]-Hydrogenases”. Chemical Reviews. 109 (6): 2245—2274. DOI:10.1021/cr800542q. PMID 19438209.
- 1 2 Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 102., stark umgearb. u. verb. Auflage. de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, p. 1780.
- ↑ F. Albert Cotton: Proposed nomenclature for olefin-metal and other organometallic complexes. In: Journal of the American Chemical Society. 90, 1968, S. 6230-6232, DOI:10.1021/ja01024a059.
- ↑ Dyson, P. J.; McIndoe, J. S. Transition Metal Carbonyl Cluster Chemistry. — Amsterdam : Gordon & Breach, 2000. — ISBN 90-5699-289-9.
- ↑ Эльшенбройх К. Металлоорганическая химия. — М.: БИНОМ. Лаборатория знаний. — 2011. С. 331 — ISBN 978-5-9963-0203-1.
- ↑ Эльшенбройх К. Металлоорганическая химия. — М.: БИНОМ. Лаборатория знаний. — 2011. С. 324 — ISBN 978-5-9963-0203-1.
- ↑ И.А.Шека, К. Ф. Карлышева. Разделение циркония и гафния в виде карбонилов 2г (СО), и ... - Справочник химика 21. Химия гафния. chem21.info (1972). Проверено 16 июля 2018.
- ↑ Allian, A. D.; Wang, Y.; Saeys, M.; Kuramshina, G. M.; Garland, M. (2006). “The Combination of Deconvolution and Density Functional Theory for the Mid-Infrared Vibrational Spectra of Stable and Unstable Rhodium Carbonyl Clusters”. Vibrational Spectroscopy. 41 (1): 101—111. DOI:10.1016/j.vibspec.2006.01.013.
- ↑ Organometallic Chemistry. — 2nd. — New York : Oxford University Press, 2010. — P. 79–82. — ISBN 978-0-19-533099-1.
- ↑ Sargent, A. L.; Hall, M. B. (1989). “Linear Semibridging Carbonyls. 2. Heterobimetallic Complexes Containing a Coordinatively Unsaturated Late Transition Metal Center”. Journal of the American Chemical Society. 111 (5): 1563—1569. DOI:10.1021/ja00187a005.
- ↑ Li, P.; Curtis, M. D. (1989). “A New Coordination Mode for Carbon Monoxide. Synthesis and Structure of Cp4Mo2Ni2S2(η1, μ4-CO)”. Journal of the American Chemical Society. 111 (21): 8279—8280. DOI:10.1021/ja00203a040.
- 1 2 3 4 Holleman, A. F.; Wiberg, E.; Wiberg, N. Lehrbuch der Anorganischen Chemie. — 102nd. — Berlin : de Gruyter, 2007. — P. 1780–1822. — ISBN 978-3-11-017770-1.
- 1 2 Londergan, C. H.; Kubiak, C. P. (2003). “Electron Transfer and Dynamic Infrared-Band Coalescence: It Looks like Dynamic NMR spectroscopy, but a Billion Times Faster”. Chemistry - A European Journal. 9 (24): 5962—5969. DOI:10.1002/chem.200305028.
- ↑ Inorganic Chemistry. — Upper Saddle River, NJ : Pearson Prentice Hall, 2011. — P. 109–119; 534–538.
- 1 2 Braterman, P. S. Metal Carbonyl Spectra. — Academic Press, 1975.
- ↑ Crabtree, R. H. 4. Carbonyls, Phosphine Complexes, and Ligand Substitution Reactions // The Organometallic Chemistry of the Transition Metals. — 4th. — 2005. — P. 87–124. — DOI:10.1002/0471718769.ch4.
- ↑ Tolman, C. A. (1977). “Steric effects of Phosphorus Ligands in Organometallic Chemistry and Homogeneous Catalysis”. Chemical Reviews. 77 (3): 313—348. DOI:10.1021/cr60307a002.
- ↑ Cotton, F. A. Chemical Applications of Group Theory. — 3rd. — Wiley Interscience, 1990. — ISBN 978-0-471-51094-9.
- ↑ Carter, R. L. Molecular Symmetry and Group Theory. — Wiley, 1997. — ISBN 978-0-471-14955-2.
- ↑ Symmetry and Spectroscopy: Introduction to Vibrational and Electronic Spectroscopy. — Oxford University Press, 1980. — ISBN 978-0-19-855152-2.
- ↑ Riedel, E.; Alsfasser, R.; Janiak, C.; Klapötke, T. M. Moderne Anorganische Chemie. — de Gruyter, 2007. — ISBN 3-11-019060-5.
- ↑ Henderson, W.; McIndoe, J. S. Mass Spectrometry of Inorganic, Coordination and Organometallic Compounds: Tools – Techniques – Tips. — John Wiley & Sons. — ISBN 0-470-85015-9.
- ↑ Butcher, C. P. G.; Dyson, P. J.; Johnson, B. F. G.; Khimyak, T.; McIndoe, J. S. (2003). “Fragmentation of Transition Metal Carbonyl Cluster Anions: Structural Insights from Mass Spectrometry”. Chemistry - A European Journal. 9 (4): 944—950. DOI:10.1002/chem.200390116. PMID 12584710.
- ↑ Vásquez, G. B.; Ji, X.; Fronticelli, C.; Gilliland, G. L. (1998). “Human Carboxyhemoglobin at 2.2 Å Resolution: Structure and Solvent Comparisons of R-State, R2-State and T-State Hemoglobins”. Acta Crystallographica D. 54 (3): 355—366. DOI:10.1107/S0907444997012250.
- ↑ Эльшенбройх К. Металлоорганическая химия. — М.: БИНОМ. Лаборатория знаний. — 2011. С. 330—331 — ISBN 978-5-9963-0203-1.
- ↑ Tielens, A. G.; Wooden, D. H.; Allamandola, L. J.; Bregman, J.; Witteborn, F. C. (1996). “The Infrared Spectrum of the Galactic Center and the Composition of Interstellar Dust” (pdf). The Astrophysical Journal. 461 (1): 210—222. Bibcode:1996ApJ...461..210T. DOI:10.1086/177049. PMID 11539170.
- ↑ Xu, Y.; Xiao, X.; Sun, S.; Ouyang, Z. (1996). “IR Spectroscopic Evidence of Metal Carbonyl Clusters in the Jiange H5 Chondrite” (pdf). Lunar and Planetary Science. 26: 1457—1458. Bibcode:1996LPI....27.1457X.
- ↑ Cody, G. D.; Boctor, N. Z.; Filley, T. R.; Hazen, R. M.; Scott, J. H.; Sharma, A.; Yoder, H. S. Jr. (2000). “Primordial Carbonylated Iron-Sulfur Compounds and the Synthesis of Pyruvate”. Science. 289 (5483): 1337—1340. Bibcode:2000Sci...289.1337C. DOI:10.1126/science.289.5483.1337. PMID 10958777.
- ↑ Feldmann, J. (1999). “Determination of Ni(CO)4, Fe(CO)5, Mo(CO)6, and W(CO)6 in Sewage Gas by using Cryotrapping Gas Chromatography Inductively Coupled Plasma Mass Spectrometry”. Journal of Environmental Monitoring. 1 (1): 33—37. DOI:10.1039/A807277I. PMID 11529076.
- ↑ Bioorganometallics: Biomolecules, Labeling, Medicine / Jaouen, G.. — Weinheim : Wiley-VCH, 2006. — ISBN 3-527-30990-X.
- ↑ Boczkowski, J.; Poderoso, J. J.; Motterlini, R. (2006). “CO–Metal Interaction: Vital Signaling from a Lethal Gas”. Trends in Biochemical Sciences. 31 (11): 614—621. DOI:10.1016/j.tibs.2006.09.001. PMID 16996273.
- 1 2 Huheey, J.; Keiter, E.; Keiter, R. Metallcarbonyle // Anorganische Chemie. — 2nd. — Berlin / New York : de Gruyter, 1995.
- ↑ Hieber, W.; Fuchs, H. (1941). “Über Metallcarbonyle. XXXVIII. Über Rheniumpentacarbonyl”. Zeitschrift für Anorganische und Allgemeine Chemie. 248 (3): 256—268. DOI:10.1002/zaac.19412480304.
- ↑ King, R. B. Organometallic Syntheses. — New York : Academic Press, 1965. — Vol. 1: Transition-Metal Compounds. — ISBN 0-444-42607-8.
- ↑ Braye, E. H.; Hübel, W.; Rausch, M. D.; Wallace, T. M. (1966). “Diiron Enneacarbonyl”. Inorganic Syntheses. 8: 178—181. DOI:10.1002/9780470132395.ch46. ISBN 978-0-470-13239-5.
- ↑ Roland, E.; Vahrenkamp, H. (1985). “Zwei neue Metallcarbonyle: Darstellung und Struktur von RuCo2(CO)11 und Ru2Co2(CO)13”. Chemische Berichte. 118 (3): 1133—1142. DOI:10.1002/cber.19851180330.
- ↑ Pike, R. D. (2001), "Disodium Tetracarbonylferrate(-II)", Encyclopedia of Reagents for Organic Synthesis, DOI 10.1002/047084289X.rd465
- ↑ Xu, Q.; Imamura, Y.; Fujiwara, M.; Souma, Y. (1997). “A New Gold Catalyst: Formation of Gold(I) Carbonyl, [Au(CO)n]+ (n = 1, 2), in Sulfuric Acid and Its Application to Carbonylation of Olefins”. Journal of Organic Chemistry. 62 (6): 1594—1598. DOI:10.1021/jo9620122.
- ↑ Ohst, H. H.; Kochi, J. K. (1986). “Electron-Transfer Catalysis of Ligand Substitution in Triiron Clusters”. Journal of the American Chemical Society. 108 (11): 2897—2908. DOI:10.1021/ja00271a019.
- ↑ Ellis, J. E. (2003). “Metal Carbonyl Anions: from [Fe(CO)4]2- to [Hf(CO)6]2- and Beyond”. Organometallics. 22 (17): 3322—3338. DOI:10.1021/om030105l.
- ↑ Finze, M.; Bernhardt, E.; Willner, H.; Lehmann, C. W.; Aubke, F. (2005). “Homoleptic, σ-Bonded Octahedral Superelectrophilic Metal Carbonyl Cations of Iron(II), Ruthenium(II), and Osmium(II). Part 2: Syntheses and Characterizations of [M(CO)6][BF4]2 (M = Fe, Ru, Os)”. Inorganic Chemistry. 44 (12): 4206—4214. DOI:10.1021/ic0482483. PMID 15934749.
- ↑ Pearson, R. G. (1995). “The Transition-Metal-Hydrogen Bond”. Chemical Reviews. 85 (1): 41—49. DOI:10.1021/cr00065a002.
- ↑ Fairweather-Tait, S. J.; Teucher, B. (2002). “Iron and Calcium Bioavailability of Fortified Foods and Dietary Supplements”. Nutrition Reviews. 60 (11): 360—367. DOI:10.1301/00296640260385801.
- ↑ Richardson, D. Stealth-Kampfflugzeuge: Täuschen und Tarnen in der Luft. — Zürich : Dietikon, 2002. — ISBN 3-7276-7096-7.
- ↑ Wilke, G. (1978). “Organo Transition Metal Compounds as Intermediates in Homogeneous Catalytic Reactions” (pdf). Pure and Applied Chemistry. 50 (8): 677—690. DOI:10.1351/pac197850080677.
- ↑ Roberto Motterlini and Leo Otterbein «The therapeutic potential of carbon monoxide» Nature Review Drug Discovery 2010, vol. 9, pp. 728-43. {{doi: 10.1038/nrd3228}}.
- ↑ Hayton, T. W.; Legzdins, P.; Sharp, W. B. (2002). “Coordination and Organometallic Chemistry of Metal−NO Complexes”. Chemical Reviews. 102 (4): 935—992. DOI:10.1021/cr000074t. PMID 11942784.
- ↑ Эльшенбройх К. Металлоорганическая химия. — М.: БИНОМ. Лаборатория знаний. — 2011. — ISBN 978-5-9963-0203-1
- ↑ Архивированная копия (недоступная ссылка). Проверено 9 ноября 2014. Архивировано 9 ноября 2014 года.
- ↑ Petz, W. (2008). “40 Years of Transition-Metal Thiocarbonyl Chemistry and the Related CSe and CTe Compounds”. Coordination Chemistry Reviews. 252 (15—17): 1689—1733. DOI:10.1016/j.ccr.2007.12.011.
- ↑ Hill, A. F.; Wilton-Ely, J. D. E. T. (2002). “Chlorothiocarbonyl-bis(triphenylphosphine) iridium(I) [IrCl(CS)(PPh3)2]”. Inorganic Syntheses. 33: 244—245. DOI:10.1002/0471224502.ch4. ISBN 0-471-20825-6.
- ↑ Madea, B. Rechtsmedizin. Befunderhebung - Rekonstruktion – Begutachtung. — Springer-Verlag, 2003. — ISBN 3-540-43885-8.
- 1 2 Stellman, J. M. Encyclopaedia of Occupational Health and Safety. — International Labour Org, 1998. — ISBN 91-630-5495-7.
- ↑ Mehrtens, G.; Reichenbach, M.; Höffler, D.; Mollowitz, G. G. Der Unfallmann: Begutachtung der Folgen von Arbeitsunfällen, privaten Unfällen und Berufskrankheiten. — Berlin / Heidelberg : Springer, 1998. — ISBN 3-540-63538-6.
Ссылки
| Карбонильные комплексы на Викискладе |
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .