| Гидрид алюминия | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Гидрид алюминия |
| Традиционные названия | Гидрид алюминия, гидрид алюминия (III), алан |
| Хим. формула | (AlH3)n |
| Рац. формула | AlH3 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 30,005 г/моль |
| Плотность | 1,45[1] |
| Термические свойства | |
| Т. разл. | 105[1] |
| Энтальпия образования | − 12[2] кДж/моль |
| Классификация | |
| Рег. номер CAS | 7784-21-6 |
| PubChem | 14488 |
| Рег. номер EINECS | 232-053-2 |
| SMILES | |
| InChI | |
| ChEBI | 30136 |
| ChemSpider | 13833 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Гидри́д алюми́ния — AlH3, неорганическое бинарное соединение алюминия с водородом. В нормальных условиях — бесцветное или белое твёрдое вещество, имеющее полимерную структуру: (AlH3)n.
Впервые был получен в 1942 году действием тлеющего электрического разряда на смесь триметилалюминия и водорода[3].
Используется как компонент ракетного топлива, мощный восстановитель в органическом синтезе и в качестве катализатора для реакций полимеризации.
Молекулярная структура



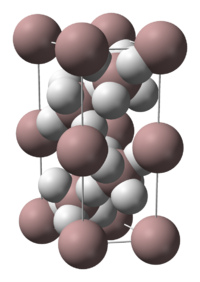
В обычных условиях гидрид алюминия имеет полимерную молекулярную структуру (AlH3)n, при этом его кристаллическая форма существует в семи полиморфных модификациях: α-(AlH3)n, α1-(AlH3)n, β-(AlH3)n, δ-(AlH3)n, ε-(AlH3)n, γ-(AlH3)n, ζ-(AlH3)n[4].
Самой устойчивой является модификация α-(AlH3)n, имеющая гексагональную сингонию (пространственная группа R3c, а = 4,449 Å, b = 4,449 Å, c = 11,804 Å). Длина связи Al—H составляет 1,72 Å, длина связи Al—Al: 3,24 Å[5]. Структура α-(AlH3)n представляет собой совокупность октаэдров АlН6, объединенных шестью трехцентровыми двухэлектронными связями Аl—Н—Аl в кристаллический каркас[6].
Модификация γ-(AlH3)n существует в ромбической сингонии, пространственная группа Pnnm (а = 5,3806 Å, b = 7,3555 Å, c = 5,77509 Å). Ячейка кристаллической решётки гидрида состоит из двух октаэдров AlH6, длина связи Al—Al составляет 2,606 Å. Особенностью структуры является наличие разветвлённой двойной мостиковой связи Al—2H—Al (длина связи Al—H: 1,68—1,70 Å) в дополнение к обычной связи Al—H—Al (длина связи Al—H: 1,77—1,78 Å). Из-за наличия больших полостей в кристаллической структуре γ-(AlH3)n, данная модификация имеет плотность примерно на 11 % меньше, чем α-(AlH3)n[7].
При взаимодействии распылённых лазером атомов алюминия с водородом при сверхнизких температурах (3,5 K) с последующим ультрафиолетовым излучением и нормализацией при 6,5 K, в продуктах фотолиза можно обнаружить структуры димера Al2H6, аналогичные структуре диборана B2H6[8]. Димер (см. структуру на рисунке) очень неустойчив в конденсированном состоянии, поэтому его существование обнаружилось лишь спустя примерно пятьдесят лет после открытия гидрида алюминия[9].
В 2007 году группа учёных из США воздействовала на алюминий плазменным потоком атомов водорода и обнаружила, что в результате образуются различные анионные полиядерные гидриды алюминия, среди которых особый интерес вызвал анион Al4H6−, чей нейтральный гибрид Al4H6 по расчётам должен отличаться заметной стабильностью. Структурно соединение должно представлять искажённый тетраэдр с вершинами — атомами алюминия, в котором атомы водорода образуют четыре терминальные связи Al–H и две мостиковые связи Al–H–Al. Большой энергетический порог между высшими занятыми и низшими свободными молекулярными орбиталями в сочетании с исключительно высоким значением теплоты сгорания позволяют предположить, что этот гидрид алюминия может представлять собой перспективный материал для ракетного топлива[10].
Физические свойства
Гидрид алюминия представляет собой твёрдое белое[11] или бесцветное[12] вещество. Плотность 1,45[1] (по другим данным 1,47[13]) г/см³. Растворим в тетрагидрофуране (5 г в 100 г растворителя при 19,5 °C)[2].
Термодинамические константы:
- стандартная энтальпия образования, ΔHo298: −12 кДж/моль[2] (по другим данным: −11,43±0,84 кДж/моль[14]);
- стандартная энтропия, So298: 30 Дж/(моль·K)[2] (по другим данным: 30,06±0,42 Дж/(моль·K)[14]);
- стандартная энергия Гиббса, ΔGo298: 46 кДж/моль[2] (по другим данным: 46,52±0,96 кДж/моль[14]).
Большое содержание водорода в гидриде алюминия обуславливает ряд его свойств, связанных с проблемой высокотемпературной сверхпроводимости: в области давлений ~60 ГПа и температуре ~1000 K он обладает полупроводниковым механизмом проводимости, а в области высоких давлений и температур (до 90 ГПа и 2000 K) его проводимость сопоставима с металлической электропроводностью водорода[15].
Химические свойства
- Соединение нестабильно: при нагревании выше 100 °C разлагается[16]:
- Бурно взаимодействует с водой[6]:
- С диэтиловым эфиром образует высокореакционный, но относительно стабильный комплекс переменного состава, который часто используется для синтетических целей[12]:
- Аналогичный комплекс образуется с другими низшими алифатическими эфирами, а также с триметиламином: AlH3 • N(CH3)3. Последний взаимодействует с водой со взрывом[12].
- Для стабилизации гидрида алюминия также можно использовать комплексы с другими аминами, например с N-метилпирролидином (NMP): AlH3 • NMP и AlH3 • (NMP)2[17].
- Гидрид алюминия — очень сильный восстановитель. Он способен восстановить углекислый газ до метана[12]:
- Известны многочисленные реакции восстановления органических соединений с использованием гидрида алюминия (см. раздел ...).
- Взаимодействует с гидридом лития, образуя алюмогидрид:
- Медленно вступает в реакцию с дибораном, образуя борогидрид алюминия (точнее тетрагидридоборат алюминия)[18]:
Получение
Используемый сегодня принципиальный метод получения чистого гидрида алюминия из гидрида лития в среде диэтилового эфира был предложен ещё в 1947 году[19]:
Хлорид лития выпадает в осадок до момента полимеризации AlH3 и отделяется от эфирного раствора, из которого путём дальнейшей отгонки эфира получают комплекс гидрида алюминия с диэтиловым эфиром[19].
Также гидрид алюминия по аналогии можно получить реакцией алюмогидрида лития с серной кислотой, хлоридом бериллия, хлоридом цинка[4], хлороводородом и алкилгалогенидами[20]:
Вместо алюмогидрида лития можно использовать алюмогидрид натрия[21]:
Для получения чистого гидрида (без примесей растворителя) эфирный комплекс подвергают нагреванию в вакууме с добавлением бензола[6] или в присутствии небольших количеств LiAlH4 или смеси LiAlH4+LiBH4[4]. При этом сперва получаются β-AlH3 и γ-AlH3 модификации, которые затем переходят в более стабильный α-AlH3[4].
Другим способом получения несольватированного эфиром гидрида алюминия, является электролиз алюмогидрида натрия в среде тетрагидрофурана[22].
Среди прочих методов отметим синтез с использованием гидрида магния[23]:
Долгое время считалось, что гидрид алюминия невозможно получить прямым взаимодействием элементов, поэтому для его синтеза использовали приведённые выше косвенные методы[24]. Однако, в 1992 году группа российских учёных осуществила прямой синтез гидрида из водорода и алюминия, используя высокое давление (выше 2 ГПа) и температуру (более 800 K). Вследствие очень жёстких условий протекания реакции, в настоящий момент метод имеет лишь теоретическое значение[13].
Применение
Гидрид алюминия находит широкое применение в органическом синтезе в качестве сильнейшего восстанавливающего агента.
В связи с тем, что гидрид алюминия представляет собой соединение с высоким содержанием водорода (10,1 %), он используется в производстве ракетных топлив и некоторых взрывчатых веществ[25], а также для систем хранения и генерации в автономных энергетических водородных установках.
См. также
Примечания
- 1 2 3 Лидин Р.А., Андреева Л.Л., Молочко В.А. Глава 3. Физические свойства // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 74. — ISBN 5-7107-8085-5.
- 1 2 3 4 5 Лидин Р.А., Андреева Л.Л., Молочко В.А. Часть IV. Термодинамика. Глава 1. Энтальпия образования, энтропия и энергия Гиббса образования веществ // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 442. — ISBN 5-7107-8085-5.
- ↑ Алюминия гидрид // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- 1 2 3 4 Brower F.M., Matzek N.E., Reigler P.F., Rinn H.W., Roberts C.B., Schmidt D.L., Snover J. A., Terada K. Preparation and Properties of Aluminum Hydride (англ.) // Journal of the American Chemical Society. — 1976. — Vol. 98, no. 9. — P. 2450—2453.
- ↑ Turley J.W., Rinn H.W. The Crystal structure of aluminum hydride (англ.) // Inorganic Chemistry. — 1969. — Vol. 8, no. 1. — P. 18—22.
- 1 2 3 Дроздов А.А., Зломанов В.П., Мазо Г.Н., Спиридонов Ф.М. Неорганическая химия. Т.2: Химия непереходных элементов / Под ред. акад. Ю.Н.Третьякова. — М.: Издательский центр «Академия», 2004. — Т. 2. — С. 83. — ISBN 5-7695-1436-1.
- ↑ Yartys V.A., Denys R.V., Maehlen J.P., Frommen Ch., Fichtner M., Bulychev B.M., Emerich H. Double-Bridge Bonding of Aluminium and Hydrogen in the Crystal Structure of γ-AlH3 (англ.) // Inorganic Chemistry. — 2007. — Vol. 46, no. 4. — P. 1051—1055.
- ↑ Andrews L., Wang X. The Infrared Spectrum of Al2H6 in Solid Hydrogen (англ.) // Science. — 2003. — Vol. 299, no. 5615. — P. 2049—2052.
- ↑ Mitzel N.W. Molecular Dialane and Other Binary Hydrides (англ.) // Angewandte Chemie International Edition. — 2003. — Vol. 42, no. 33. — P. 3856—3858.
- ↑ Li X., Grubisic A., Stokes S.T., Cordes J., Ganteför G.F., Bowen K.H., Kiran B., Willis M., Jena P., Burgert R., Schnöckel H. Unexpected Stability of Al4H6: A Borane Analog? (англ.) // Science. — 2007. — Vol. 315, no. 5810. — P. 356—358.
- ↑ Ахметов Н.С. Общая и неорганическая химия. Учебник для вузов. — 4-е изд., исправленное. — М.: «Высшая школа», 2001. — С. 500. — ISBN 5-06-003363-5.
- 1 2 3 4 Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — P. 8—9. — ISBN 0-07-049439-8.
- 1 2 Булычев Б.М., Стороженко П.А. Молекулярные и ионные гидриды металлов как источники водорода для энергетических установок // Альтернативная энергетика и экология. — 2004. — № 4. — С. 5—10. Архивировано 5 марта 2016 года.
- 1 2 3 Sinke G.C., Walker L.C., Oetting F.L., Stull D.R. Thermodynamic Properties of Aluminum Hydride (англ.) // The Journal of Chemical Physics. — 1967. — Vol. 47, no. 8. — P. 2759—2761. (недоступная ссылка)
- ↑ Молодец А.М., Шахрай Д.В., Храпак А.Г., Фортов В.Е. Презентация: Металлизация гидрида алюминия AlH3 при высоких давлениях ступенчатого ударного сжатия (pdf). Научно-координационная сессия «Исследования неидеальной плазмы». Институт теплофизики экстремальных состояний ОИВТ РАН. — С. 11. Проверено 17 февраля 2010. Архивировано 18 апреля 2012 года.
- ↑ Алюминий // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 207.
- ↑ Li H., Meziani M.J., Kitaygorodskiy A., Lu F., Bunker Ch.E., Shiral Fernando K. A., Guliants E.A., Ya-Ping Sun. Preparation and Characterization of Alane Complexes for Energy Applications (англ.) // The Journal of Physical Chemistry C : Web publication (February 4, 2010). — 2010.
- ↑ Chambers C., Holliday A.K. Modern inorganic chemistry. — Chichester: Butterworth & Co (Publishers) Ltd, 1975. — P. 148.
- 1 2 Finholt A.E., Bond A.C. Jr., Schlesinger H.I. Lithium Aluminum Hydride, Aluminum Hydride and Lithium Gallium Hydride, and Some of their Applications in Organic and Inorganic Chemistry (англ.) // Journal of The American Chemical Society. — 1947. — Vol. 69, no. 5. — P. 1199—1203.
- ↑ Mirsaidov U. Synthesis, Properties, and Assimilation Methods of Aluminium Hydride (англ.) // Edited by T. Nejat Veziroğlu, Svetlana Yu Zaginaichenko, Dmitry V. Schur, Bogdan Baranowski, Anatoliy P. Shpak Hydrogen Materials Science and Chemistry of Carbon Nanomaterials : NATO Science for Peace and Security Series / NATO Science for Peace and Security Series A:. — Springer, 2007. — P. 77—85. — ISBN 978-1-4020-5512-6.
- ↑ Zakharkin L.I., Gavrilenko V.V. A simple method for the preparation of sodium and potassium aluminium hydrides (англ.) // Russian Chemical Bulletin. — 1961. — Vol. 10, no. 12. — P. 2105—2106.
- ↑ Clasen Dr.H. Alanat-Synthese aus den Elementen und ihre Bedeutung (нем.) // Angewandte Chemie. — 1961. — Bd. 73, Nr. 10. — S. 322—331.
- ↑ Method for synthesizing aluminum hydride. United States Patent 5670129 (англ.) (pdf). FreePatentsOnline.com (09.23.1997). Проверено 15 февраля 2010. Архивировано 18 апреля 2012 года.
- ↑ Тихонов В.Н. Аналитическая химия алюминия. — Серия «Аналитическая химия элементов». — М.: «Наука», 1971. — С. 11.
- ↑ Молодец А.М., Шахрай Д.В., Храпак А.Г., Фортов В.Е. Металлизация гидрида алюминия AlH3 при высоких давлениях ступенчатого ударного сжатия (pdf). Научно-координационная сессия «Исследования неидеальной плазмы». Институт теплофизики экстремальных состояний ОИВТ РАН. Проверено 17 февраля 2010. Архивировано 18 апреля 2012 года.
Литература
- Антонова М.М., Морозова Р.А. Препаративная химия гидридов. — Киев: «Наукова Думка», 1976. — С. 65—68.
- Семененко К.Н., Булычев Б.М., Шевлягина Е.А. Гидрид алюминия // Успехи химии. — 1966. — Т. 35, № 9. — С. 1529—1548.
- Downs A.J. Chemistry of aluminium, gallium, indium, and thallium. — First edition. — London: Chapman & Hall, 1993. — 526 p. — ISBN 0-7514-0103-X.
Ссылки
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .














