Необходимо проверить качество перевода и привести статью в соответствие со стилистическими правилами Википедии. |
VHL (сокр. от нем. Von Hippel–Lindau), также опухолевый супрессор VHL или pVHL — белок-онкосупрессор (антионкобелок), который кодируется одноимённым геном VHL, расположенным на коротком плече (p-плече) 3-ей хромосомы[1][2]. Мутация гена VHL связана с аутосомно-доминантным заболеванием — болезнью Гиппеля—Линдау[3]. Большинство спорадических светлоклеточных карцином почек характеризуются инактивацией гена-онкосупрессора VHL[4].
Белок состоит из остатков 213 аминокислот, молекулярная масса составляет 24 153 Да[5].
Название белка VHL происходит от названия болезни (von Hippel-Lindau). Впервые его название было использовано в мартовском номере 1988 года журнала Nature, в статье исследователями Bernd Seizinger и его сотрудниками был установлен локус предполагаемого патогенного гена в локусе 3p25[6].
Структура гена
Ген VHL локализуется на 3-ей хромосоме в локусе 3p26-p25. Ген VHL включает в себя 3 экзона и 642 пары нуклеотидов ДНК[7].
Два из стартовых кодонов гена в первом экзоне приводят к экспрессии двух форм белка VHL. Первый экзон насчитывает 213 пар нуклеотидов, которые транскрибируются на молекулу мРНК, начиная с первого стартового кодона, тогда как второй стартовый кодон находится в положении 54 и предшествует кодирующей последовательности инициации трансляции. Транскрипция гена из этого исходного сайта и трансляция мРНК приводят к синтезу белка VHL1, состоящего из 160 аминокислот, обозначенного VHL19[8], в отличие от первой формы белка с более высокой молекулярной массой — VHL30[9]. Было обнаружено, что изоформы VHL30 в основном локализуются в цитоплазме, а изоформа VHL19 — в клеточном ядре; это указывает на то, что выполняемые функции данных белков не идентичны[10][11]. В одном исследовании присутствие pVHL в митохондриях было продемонстрировано с помощью меченых GFP антител[12]. Когда молекулярная масса не имеет отношения к описанию функции белка, то используется обозначение pVHL.
Было обнаружено, что транскрипт pVHL мРНК альтернативно сплайсирован, что выражается наличием в клетке двух изоформ мРНК, один из которых имеет экзон 2, а другой без экзона. Поскольку, люди с мутированным геном VHL лишены экзона 2 и имеют ярко выраженные симптомы болезни von Hippel—Lindau, то похоже, что только более длинная белковая изоформа действует как супрессор. До сих пор не доказано, что альтернативные сплайсирующие мРНК являются трансляционными in vivo[13].

Промоторная последовательность гена VHL богата репликатами GC, не имеет ТАТА-бокса и CCAAT-последовательности; Возникновение транскрипции, вероятно, происходит в точке, предполагающей связывание белка Sp1, 60 пар оснований в направлении 5'-конца нити ДНК от первого стартового кодона VHL. Последовательность промотора имеет множество предсказуемых сайтов для связывания факторов транскрипции, но до сих пор не был идентифицирован механизм контроля экспрессии гена VHL. Последовательность кодирования гена предшествует 3’UTR-области, имеющей 11 повторов Alu[15].
Экспрессия гена
Экспрессия гена VHL не ограничена органами, из которых развиваются опухоли при болезни von Hippel—Lindau. Она происходит во многих типах клеток как у плода, так и у взрослых организмов[7]. В ходе эмбриогенеза мРНК гена VHL была обнаружена практически во всех типах тканей с 6-ой недели жизни. Но особенно большое количество мРНК VHL были найдены в тканях урогенитального тракта, головного мозга, спинного мозга, спинальных ганглиях, глазного нерва и эпителия бронхов[13]. Распределение усиленной экспрессии гена VHL точно не соответствует тканям при болезни von Hippel—Lindau[14]. В развивающейся нормальной почке (метанефрос) VHL экспрессируется в проксимальной канальце (из которого возникает карцинома почки), но белок pVHL в изобилии синтезируется в петле Генле[13][16]. Нет никаких свидетельств различий в экспрессии двух форм белка VHL19 и VHL30 между различными тканями плода.
Функции

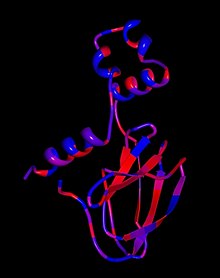

Белок pVHL воздействует на клетки в комплексе, состоящем из многочисленных белков, которые прямо или косвенно взаимодействуют с ним, посредством образования связей. На сегодняшний день известно, что эта группа белков включает:
- элонгин C[18] и элонгин B[18], CUL2[19] и Rbx1 (также называемый ROC1 или Hrt1)[20]; В комплекс также входит ацетилтрансфераза SSAT2[21];
- HIF-1[22];
- фибронектин[23];
- тубулин-формирующие микротрубочки[11];
- sp1 транскрипционный фактор[24];
- протеинкиназы C (PKC-δ изотипы, PKC-ζ и PKC-λ)[25][26];
- белки из семейства деубиквитинизирующих ферментов, VDU1 и VDU2 (VHL-взаимодействующий деубиквитинирующий фермент-1/2)[27][28];
- белок-онкосупрессор P53[29];
- гиперфосфорилированный Rpb1-белок, субъединицы РНК-полимеразы II[30];
- имидопептидаза, которая прикрепляется к N-концу белка в аминокислотных остатках 1-57;
- Tat 1 связывающий белок (белок Tat 1 вируса иммунодефицита человека (ВИЧ-1)) прикрепляется к области pVHL 1: 87;
- Филамин (актинсвязывающий белок, АБП) также прикрепляется к этой области.
При высоких концентрациях в клетке молекулы белка pVHL могут связываться друг с другом через аминокислотные остатки 96-122, но не было продемонстрировано, чтобы молекулы pVHL связывались друг с другом при физиологических (нормальных) концентрациях[31].
Основные функции, выполняемые белком pVHL:
- в комплексе с элонгином C, элонгином B и куллином (CUL2) с активной убиквитинлигазы E3 в качестве субстратного белка участвует в убиквитинировании белка HIF1-α[32], который разрушает белок HIF1-α в протеасоме и ингибирует транскрипцию индуцированных гипоксией генов, активированных HIF1-α;
- ингибирование транскрипции определённых факторов роста (например, VEGF) через Sp1;
- модификация внутриклеточных сигнальных процессов, посредством ингибирования атипичных путей белка протеинкиназами PKC-δ, PKC-ζ и PKC-λ, а также путём убиквитинирования[25][26][33];
- при связывании с фибронектином pVHL может влиять на образование внеклеточного матрикса[14];
- связывание с тубулином из микротрубочек ингибирует их деполимеризацию; Эта функция pVHL не зависит от активности убиквитинлигазы Е3, входящей в комплекс VBC, потому что мутантный pVHL-белок, не имеющий элонгин С связывающего сайта, сохраняет способность стабилизации микротрубочек[11];
- Необъяснимым образом контролирует клеточный цикл; VHL-/- (не содержащие VHL) клетки не могут покинуть цикл после экспериментального ответа на такой фактор, как удаление сыворотки культуральной среды[34][35]; Возможность выхода из клеточного цикла была восстановлена при введении pVHL; Контроль цикла с помощью pVHL проявляется многофакторно: два исследования показали, что pVHL ингибирует циклин D1, который является митогеном[36][37]; В другом исследовании показано, что pVHL ингибирует TGF-α, ген которого недавно был идентифицирован как регулируемый белком HIF[38].
В одном исследовании было продемонстрировано, что pVHL связывается in vivo с белком P53, стабилизируя и предотвращая убиквитинирование P53 белком Mdm2; Кроме того, в условиях повреждения ДНК (генотоксический стресс) pVHL способствует взаимодействию белков P53 и P300 и последующему ацетилированию P53, что приводит к увеличению транскрипционной активности этого белка и эффективной остановки клеточного цикла и, как следствие к индукции апоптоза. По-видимому, это может быть искомый, нелетальный механизм действия HIF-α, в котором pVHL выполняет роль супрессорного белка[29]. Важность взаимодействия pVHL с филамазой и ВИЧ-связывающим белком Tat неясна[13].
Регуляция функций
В пределах нуклеотидной последовательности гена VHL было найдено несколько консенсусных киназных последовательностей, поэтому регулирование функции белка pVHL может основываться на киназном фосфорилировании[14]. Недавно было показано, что VHL30 является субстратом для киназы 3 гликогенсинтазы (GSK3) in vitro и in vivo[39]. Фермент фосфорилирует VHL30 по сериновому остатку 68; прежде белок должен быть фосфорилирован на серине 72, который in vitro катализирует казеинкиназу I. Как показано в той же работе, мутантный некиназный VHL30-белок не имеет функции стабилизации микротрубочек.
Эквиваленты гена VHL у животных

Генетическая последовательность VHL высоко консервативна у гомологичных человекообразных приматов и грызунов[40][41]. Гомологичный ген был обнаружен у нематод Caenorhabditis elegans[40] и в плодовой мушке[42]. Сохранение последовательностей генов особенно велико в областях, связывающих домены с другими белками[43]. Комплекс pVHL-элонгин B-элонгин С напоминает комплекс SCF у дрожжей, который проявляет функцию полиубиквитинирования белков посредством их протеолиза. Элонгин C и Cul2 представляют собой, соответственно эквивалентные дрожжевые белки Skp1 и Cdc53. Сходство этих белков было подтверждено позже предположением о том, что белковый комплекс pVHL функционирует в клетках человека как убиквитин-E3-лигаза[44]. Область гена VHL между кодонами 14-53, кодирует восемь репликатов, содержащие кислые аминокислоты (с повышенным содержанием карбоксильных групп) [Gly-X-Glu-Glu-X]8 (GXEEX8), которая гомологична мембранному белку Trypanosoma brucei[en][40]. Значение этого факта остается неизвестным[14].
Патологии, связанные с мутацией гена VHL
| Общий объём описанной мутации | 823 |
| Сдвигов рамки считывания | 297 (36,08 %) |
| Делеции | 235 (28,55 %) |
| Инсерции | 62 (7,53 %) |
| Точечные мутации | 496 (60,27 %) |
| Миссенс-мутации | 399 (48,48 %) |
| Нонсенс-мутации | 97 (11,79 %) |
| G>A | 29 |
| G>A w CpG | 42 |
| C>T | 65 |
| C>T at CpG | 57 |
| A>T | 10 |
| A>G | 20 |
| A>C | 17 |
| T>G | 20 |
| T>C | 76 |
| T>A | 29 |
| C>A | 30 |
| C>G | 47 |
| G>T | 41 |
| G>C | 29 |
| Комплексные мутации | 2 (0,24 %) |
Гомозиготные мыши с VHL-/- живут 10,5-12,5 дней внутриутробной жизни; причиной выкидыша является нарушение вагулогенетики плаценты. Вероятно, это очень редкая мутация обоих аллелей VHL, которая у людей также препятствует раннему развитию эмбриона[46][47].
Как упоминалось ранее, мутация гена VHL у гетерозигот человека почти всегда вызывает болезнь von Hippel—Lindau. Клиническое распространение заболевания из-за частоты отдельных симптомов, особенно светлоклеточной карциномы почки и феохромоцитомы, коррелирует с характером мутации в гене VHL. Таким образом, большое количество делеций и преждевременное прекращение трансляции, приводящие к укороченной молекуле pVHL, характерны для заболевания типа 1, и точечные мутации, особенно миссенс, отвечают за тип 2[14]. Известно более 500 различных мутаций зародышевой линии в гене VHL; все случаи новых мутаций сообщаются в международный реестр.
| Тип | Тип мутации | Молекулярный дефект | HB R | HB CNN | RCC | Pheo | GEP |
|---|---|---|---|---|---|---|---|
| 1 | Делеции, нонсенс | Гиперэкспрессия HIF и сверхэкспрессия генов ответа гипоксии | + |
+ |
+ |
- |
- |
| 2A | Миссенс | Гиперэкспрессия HIF и сверхэкспрессия генов ответа гипоксии Дестабилизация микротрубочек |
+ |
+ |
- |
+ |
+ |
| 2B | Миссенс | Гиперэкспрессия HIF и сверхэкспрессия генов ответа гипоксии | + |
+ |
+ |
+ |
+ |
| 2C | Миссенс | Нарушение ECM-образования фибронектином Механизм зависит от P53 (?) |
- |
- |
- |
+ |
? |
| HB R — гемангиомы сетчатки; HB CNN — гемангиомы центральной нервной системы; RCC — карцинома почек; Pheo — феохромоцитома; GEP — нейроэндокринная опухоль поджелудочной железы | |||||||
Соматические мутации в гене VHL также обнаружены в спорадических опухолях почек и зародышевых клетках. Соматическая мутация гена VHL встречается примерно в 50 % случаев спорадического рака почки, и примерно в 10-20 % ген гиперметилируется[14]. Сообщалось также о 30 % случаев спорадических эмбриональных аномалий, но гиперметилирование VHL до сих пор не обнаруживалось в опухолевых клетках[14]. LOH (сокр. от англ. loss of heterozygosity — утрата гетерозиготности) гена VHL описана в спорадических панкреатических микрососудистых аденомах[49] и эндотелиальных опухолях (ELST)[50]. Мутации VHL встречаются редко при спорадической феохромоцитоме и очень редки в других формах рака: лёгких, молочной железы, яичника, яичек, шейки матки, эндометрия, простаты, колоректальный рак, карцинома мочевого пузыря, рака кожи (злокачественная меланома), плевральной карциномы, плоскоклеточной карциномы полового члена и фолликулярного рака щитовидной железы[13].
Недавно было высказано предположение, что делеция дистальных участков 11q 3-ей хромосомы в клетках нейробластомы и связанная с этим потеря гена VHL в данных клетках, могут быть причиной более агрессивного фенотипа болезни[51]. Это было бы связано с предыдущими сообщениями о дифференцировке клеток незрелых опухолей нейробластомы под влиянием гипоксии, связанной с более агрессивным курсом[52]. Наблюдалась сильная корреляция между сниженными уровнями мРНК VHL и низкой выживаемостью пациентов (p = 0,013). По-видимому, наивысшая прогностическая ценность VHL обнаружена в опухолях, экспрессирующих NTRK1 (TRKA)[51].
| Мутация | OMIM | Тип мутации | Тип болезни (комментарии) |
|---|---|---|---|
| Leu63Pro | 608537.0016 | VHL | |
| Arg64Pro | 608537.0015 | VHL | |
| Ile75DEL (Ile146DEL) | 608537.0001 | 437 делеция 3 п.н. | VHL тип 1 |
| Phe76DEL | 226-228 делеция TTC | VHL (9 семей в UMD Central[53]) | |
| 76DEL | 227-229 делеция TCT | VHL (6 семей в UMD Central[53]) | |
| Asn78Ser/His/Ter | |||
| Ser80Leu | VHL тип 2C[54] | ||
| Pro81Ser | 608537.0020 | Транзиция 454C>T | VHL тип 2C |
| Val84Leu (Val155Leu) | 608537.0025 | Трансверсия 463G>T | VHL тип 2C[55] |
| Pro86Leu | |||
| Gly93Ser | 608537.0026 | Транзиция 490G>A | Спорадическая феохромоцитома[56] |
| Tyr112His | 608537.0012 | VHL тип 2A | |
| Tyr112Asn | 608537.0017 | Трансверсия 547T>A | VHL |
| Asp126Tyr | 608537.0022 | ECYT2[57] | |
| Val130Leu | 608537.0021 | ECYT2[57] | |
| Leu135Phe | 608537.0008 | Трансверсия 618A>C | Спорадическая гемангиома эмбрионального мозжечка[58] |
| 147DEL | Делеция T | VHL (5 семей в UMD Central[53]) | |
| Ser149Ala | 658G>T[59] | ||
| Trp159Ser (Trp88Ser) | 608537.0007 | Трансверсия 476G>C | VHL спорадическая гемангиома эмбрионального мозжечка[58] |
| Arg161TER | 608537.0006 | Транзиция 694C>T | VHL тип 1 спорадическая кистозная аденома придатка яичка[60] |
| Cys162Tyr/Phe/Trp | |||
| Leu163Pro | 608537.0018 | Транзиция 701T>C | RCC |
| Val166Phe | 608537.0013 | VHL тип 2A | |
| Arg167Trp (Arg23Trp) | 608537.0003 | Транзиция 712C>T | VHL typu 2B |
| Arg167Gly | 608537.0004 | VHL тип 2B | |
| Arg167Gln | 608537.0005 | VHL тип 2B | |
| Tyr169His (Tyr98His) | 608537.0009 | Транзиция 505T>C | VHL тип 2A (мутация Black Forrest)[61][62] |
| Leu178Pro | |||
| Ser183TER (Ser254TER) | 608537.0002 | Трансверсия 761C>A | RCC |
| Leu188Val | 608537.0014 | VHL тип 2C[63][64] | |
| His191Asp | 608537.0024 | Трансверсия 571C>G | ECYT2[57] |
| Pro192Ser | 608537.0023 | Транзиция 574C>T | ECYT2[57] |
| Arg200Trp | 608537.0019 | Транзиция 598C>T | ECYT2[65] |
VHL — болезнь von Hippel—lindau
RCC — карцинома почек
ECYT — семейная эритроцитемия тип 2
Взаимодействия с белками
VHL взаимодействует со следующими белками:
Примечания
- ↑ Human chromosome 3 map view. // Vertebrate Genome Annotation (VEGA) database. Проверено 23 февраля 2016. Архивировано 5 апреля 2012 года.
- ↑ HUGO Gene Nomenclature Commitee, HGNC:12687 (англ.). Проверено 21 сентября 2017.
- ↑ Ben-Skowronek I, Kozaczuk S (2015). “Von Hippel–Lindau Syndrome”. Hormone Research in Pædiatrics. 84 (3): 145—52. DOI:10.1159/000431323. PMID 26279462.
- ↑ Bodmer D, Hurk W, van Groningen JJ, Eleveld MJ, Martens GJ, Weterman MA, van Kessel AG (2002). “Understanding familial and non-familial renal cell
cancer”. Human Molecular Genetics. 11 (20): 2489–2498. PMID 12351585. Символ переноса строки в
|title=на позиции №51 (справка) - ↑ UniProt, P40337 (англ.).
- ↑ Seizinger BR, Rouleau GA, Ozelius LJ, Lane AH, Farmer GE, Lamiell JM, Haines J, Yuen JW, Collins D, Majoor-Krakauer D; et al. (1988). “Von Hippel-Lindau disease maps to the region of chromosome 3 associated with renal cell carcinoma”. Nature. 6161 (332): 268–269. PMID 2894613.
- 1 2 Latif, F, Tory, K, Gnarra, J, Yao, M, Duh, FM, Orcutt, ML, Stackhouse, T, Kuzmin, I, Modi, W, Geil, L; et al. (1993). “Identification of the von Hippel-Lindau disease tumor suppressor gene”. Science. 5112 (260): 1235. PMID 8493574.
- ↑ Schoenfeld, A, Davidowitz, EJ, Burk, RD (1998). “A second major native von Hippel-Lindau gene product, initiated from an internal translation start site, functions as a tumor suppressor”. Proc Nat Acad Sci (95): 8817–8822. Текст "PMID 9671762" пропущен (справка)
- ↑ Iliopoulos, O, Kibel, A, Gray, S, Kaelin, WG, Jr (1995). “Tumour suppression by the human von Hippel-Lindau gene product”. Nature Medicine. 1: 822–826. Текст "PMID 7585187" пропущен (справка)
- ↑ Iliopoulos, O, Onh, M, Kaelin, WG, Jr (1998). “pVHL19 is a biologically active product of the von Hippel-Lindau gene arising from internal translation initiation”. Proc Natl Acad Sci USA. 95: 11661–11666. PMID 9751722.
- 1 2 3 Hergovich, A, Lisztwan, J, Barry, R, Ballschmieter, P, Krek, W (2003). “Regulation of microtubule stability by the von Hippel-Lindau tumour supressor protein pVHL”. Natl Cell Biol. 5: 64–70. PMID 12510195.
- ↑ Shiao, YH, Resau JH, Nagashima K, Anderson LM, Ramakrishna G (2000). “The von Hippel-Lindau tumor suppressor targets to mitochondria”. Cancer Res. 11 (60): 2816–2819. PMID 20306593.
- 1 2 3 4 5 Richards, FM, Schofield, PN, Fleming, S, Maher, ER (1996). “Expression of the von Hippel-Lindau disease tumor supressor gene during human embryogenesis”. Hum Mol Genet. 5: 639–644. PMID 8733131.
- 1 2 3 4 5 6 7 8 Richards, FM (2001). “Molecular pathology of von Hippel-Lindau disease and the VHL tumor supressor gene”. Expert Reviews in Molecular Medicine.
- ↑ Renbaum, P, Duh, FM, Latif, F, Zbar, B, Lerman, MI, Kuzmin, I (1996). “Isolation and characterization of the full-length 3' untranslated region of the human von Hippel-Lindau tumor suppressor gene”. Human Genetics. 9 (98): 666–671. PMID 8931697.
- ↑ Kessler, PM (1995). “Expression of the Von Hippel-Lindau tumor suppressor gene, VHL, in human fetal kidney and during mouse
embryogenesis”. Mol Med. 1: 457–466. PMID 96091369 Проверьте параметр
|pmid=(справка на английском). Символ переноса строки в|title=на позиции №103 (справка) - 1 2 3 4 Model utworzony na podstawie danych z Min JH, Yang, H, Ivan, M, Gertler, F, Kaelin Jr, WG, Pavletich, NP (2002). “Structure of an HIF-1alpha-pVHL complex: hydroxyproline recognition in signaling”. Science. 5574 (296): 1886–1889. PMID 12004076. (PDBid=1LM8), przy wykorzystaniu MBT Protein Workshop.
- 1 2 Kibel, A, Iliopoulos, O, DeCaprio, JA, Kaelin, WG (1995). “Binding of the von Hippel-Lindau tumor suppressor protein to Elongin B and C”. Science. 5229 (269): 1400–1401. PMID 7660130.
- ↑ Pause A, Lee, S, Worrell, RA, Chen, DY, Burgess, WH, Linehan, WM, Klausner, RD (1997). “The von Hippel-Lindau tumor-suppressor gene product forms a stable complex with human CUL-2, a member of the Cdc53 family of proteins”. Proc Natl Acad Sci U S A. 6 (94): 2156–2161. PMID 9122164.
- ↑ Kamura, T, Conrad, MN, Yan, Q, Conaway, RC, Conaway, JW (1999). “The Rbx1 subunit of SCF and VHL E3 ubiquitin ligase activates Rub1 modification of cullins Cdc53 and Cul2”. Genes Dev. 13: 2928–2933.
- ↑ Baek, JH, Liu, YV, McDonald, KR, Wesley, JB, Hubbi, ME, Byun, H, Semenza, GL (2007). “SSAT2 is an essential component of the Ubiquitin ligase complex that regulates HIF-1alpha”. J Biol Chem (Epub). PMID 17558023.
- ↑ Maxwell, PH, Wiesener, MS, Chang, GW, Clifford, SC, Vaux, EC, Cockman, ME, Wykoff, CC, Pugh, CW, Maher, ER, Ratcliffe, PJ (1999). “The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis”. Nature. 6733 (399): 271–275. PMID 10353251.
- ↑ Ohh, M, Yauch, RL, Lonergan, KM, Whaley, JM, Stemmer-Rachamimov, AO, Louis, DN, Gavin, BJ, Kley, N, Kaelin, WG, Iliopoulos, O (1998). “The von Hippel-Lindau tumor suppressor protein is required for proper assembly of an extracellular fibronectin matrix”. Mol Cell. 7 (1): 959–968. PMID 9651579.
- ↑ Mukhopadhyay, D, Knebelmann, B, Cohen, HT, Ananth, S, Sukhatme, VP (1997). “The von Hippel-Lindau tumor suppressor gene product interacts with Sp1 to repress vascular endothelial growth factor promoter activity”. Mol Cell Biol. 17: 5629–5639. PMID 97415639 Проверьте параметр
|pmid=(справка на английском). - 1 2 Okuda, H, Saitoh, K, Hirai, S, Iwai, K, Takaki, Y, Baba, M, Minato, N, Ohno, S, Shuin, T (2001). “The von Hippel-Lindau tumor suppressor protein mediates ubiquitination of activated atypical protein kinase C”. J Biol Chem. 47 (276): 43611–43617. PMID 11574546.
- 1 2 Pal, S, Claffey, KP, Dvorak, HF, Mukhopadhyay, D (1997). “The von Hippel-Lindau gene product inhibits vascular permeability factor/ vascular endothelial growth factor expression in renal cell carcinoma by blocking protein kinase C pathways”. J Biol Chem (272): 27509–27512. PMID 98010573 Проверьте параметр
|pmid=(справка на английском). - ↑ Li, Z, Wang, D, Na, X, Schoen, SR, Messing, EM, Wu, G (2002). “Identification of a deubiquitinating enzyme subfamily as substrates of the von Hippel-Lindau tumor suppressor”. Biochem Biophys Res Commun. 3 (294): 700–709. PMID 12056827.
- ↑ Li, Z, Na, X, Wang, D, Schoen, SR, Messing, EM, Wu, G. “Ubiquitination of a novel deubiquitinating enzyme requires direct binding to von Hippel-Lindau tumor suppressor protein”. J Biol Chem. 7 (277): 4656–4662. PMID 11739384. Неизвестный параметр
|rok=(предлагается|date=) (справка на английском) - 1 2 Roe, J, Kim, H, Lee, S, Kim, S, Cho, E, Youn, H. “p53 Stabilization and Transactivation by a von Hippel-Lindau Protein”. Molecular Cell. 3 (22): 395–405. PMID 16678111.
- ↑ Kuznetsova AV, Meller J, Schnell PO, Nash JA, Ignacak ML, Sanchez Y, Conaway JW, Conaway RC, Czyzyk-Krzeska MF (2003). “von Hippel-Lindau protein binds hyperphosphorylated large subunit of RNA polymerase II through a proline hydroxylation motif and targets it for ubiquitination”. Proc Natl Acad Sci U S A. 5 (100): 2706–2711. PMID 12604794.
- ↑ Cohen, HT, Zhou, M, Welsh, AM, Zarghamee, S, Scholz, H, Mukhopadhyay, D, Kishida, T, Zbar, B, Knebelmann, B, Sukhatme, VP (1999). “An important von Hippel-Lindau tumor suppressor domain mediates Sp1-binding and self-association”. Biochem Biophys Res Commun. 1 (266): 43–50. PMID 10581162.
- ↑ Iwai, K, Yamanaka, K, Kamura, T, Minato, N, Conaway, RC, Conaway, JW, Klausner, RD, Pause, A (1999). “Identification of the von Hippel-lindau tumor-suppressor protein as part of an active E3 ubiquitin ligase complex”. Proc Natl Acad Sci U S A. 22 (96): 12436–12441. PMID 10535940.
- ↑ Datta, K, Nambudripad, R, Pal, S, Zhou, M, Cohen, HT, Mukhopadhyay, D. “Inhibition of insulin-like growth factor-I-mediated cell signaling by the von Hippel-Lindau gene product in renal cancer”. J Biol Chem. 27 (275): 20700–20706. PMID 10748176.
- ↑ Davidowitz, EJ, Schoenfeld, AR, Burk, RD (2001). “VHL induces renal cell differentiation and growth arrest through integration of cell-cell and cell-extracellular matrix signaling”. Mol Cell Biol. 3 (21): 865–874. PMID 11154273.
- ↑ Pause, A, Lee, S, Lonergan, KM, Klausner, RD (1998). “The von Hippel-Lindau tumor suppressor gene is required for cell cycle exit upon serum withdrawal”. Proc Natl Acad Sci U S A. 3 (95): 993–998. PMID 9448273.
- ↑ Bindra, RS, Vasselli, JR, Stearman, R, Linehan, WM, Klausner, RD (2002). “VHL-mediated hypoxia regulation of cyclin D1 in renal carcinoma cells”. Cancer Res. 11 (62): 3014–3019. PMID 12036906.
- ↑ Zatyka, M, da Silva, NF, Clifford, SC, Morris, MR, Wiesener,MS, Eckardt, KU, Houlston, RS, Richards, FM, Latif, F, Maher, ER (2002). “Identification of cyclin D1 and other novel targets for the von Hippel-Lindau tumor suppressor gene by expression array analysis and investigation of cyclin D1 genotype as a modifier in von Hippel-Lindau disease”. Cancer Res. 13 (62): 3803–11. PMID 12097293.
- ↑ Gunaratnam, L, Morley, M, Franovic, A, de Paulsen, N, Mekhail, K, Parolin, DA, Nakamura, E, Lorimer, IA, Lee, S (2003). “Hypoxia inducible factor activates the transforming growth factor-alpha/epidermal growth factor receptor growth stimulatory pathway in VHL(-/-) renal cell carcinoma cells”. J Biol Chem. 45 (278): 44966–44974. PMID 12944410.
- ↑ Hergovich, A, Lisztwan, J, Thoma, CR, Wirbelauer, C, Barry, RE, Krek, W (2006). “Priming-dependent phosphorylation and regulation of the tumor suppressor pVHL by glycogen synthase kinase 3”. Mol Cell Biol. 15 (26): 5784–96. PMID 16847331.
- 1 2 3 Woodward, ER, Buchberger, A, Clifford, SC, Hurst, LD, Affara, NA, Maher, ER. “Comparative sequence analysis of the VHL tumor suppressor gene”. Genomics. 3 (65): 253–265. PMID 10857749.
- ↑ Gao J, Naglich JG, Laidlaw J, Whaley JM, Seizinger BR, Kley N (1995). “Cloning and characterization of a mouse gene with homology to the human von Hippel-Lindau disease tumor suppressor gene: implications for the potential organization of the human von Hippel-Lindau disease gene”. Cancer Res. 4 (55): 743–747. PMID 7850784.
- ↑ Adryan, B, Decker, HJ, Papas, TS, Hsu, T (200). “Tracheal development and the von Hippel-Lindau tumor suppressor homolog in Drosophila”. Oncogene. 24 (19): 2803–2811. PMID 10851083.
- ↑ Aso, T, Yamazaki, K, Aigaki, T, Kitajima, S (2000). “Drosophila von Hippel-Lindau tumor suppressor complex possesses E3 ubiquitin ligase activity”. Biochem Biophys Res Commun. 1 (276): 355–361. PMID 11006129.
- ↑ Stebbins, CE, Kaelin, WG, Pavletich, NP (1999). “Structure of the VHL-ElonginC-ElonginB complex: implications for VHL tumor suppressor function”. Science. 5413 (284): 455–461. PMID 10205047.
- ↑ http://194.167.35.168:2200/4DACTION/W_PART_M
- ↑ Gnarra, JR, Ward, JM, Porter, FD, Wagner, JR, Devor, DE, Grinberg, A, Emmert-Buck, MR, Westphal, H, Klausner, RD, Linehan, WM (1997). “Defective placental vasculogenesis causes embryonic lethality in VHL-deficient mice”. Proc Natl Acad Sci U S A (94): 9102–9107. PMID 97404355 Проверьте параметр
|pmid=(справка на английском). - ↑ Kaelin WG (January 2007). “The von Hippel–Lindau tumor suppressor protein and clear cell renal carcinoma”. Clinical Cancer Research. 13 (2 Pt 2): 680s–684s. DOI:10.1158/1078-0432.CCR-06-1865. PMID 17255293.
- ↑ Shuin, T, Yamasaki, I, Tamura, K, Okuda, H, Furihata, M, Ashida, S (2006). “Von Hippel-Lindau disease: molecular pathological basis, clinical criteria, genetic testing, clinical features of tumors and treatment”. Japanese Journal of Clinical Oncology. 6 (36): 337–343. PMID 16818478.
- ↑ Vortmeyer, AO; et al. (1997). “Allelic deletion and mutation of the von Hippel-Lindau (VHL) tumor suppressor gene in pancreatic microcystic adenomas”. Am J Pathol. 151: 951–956. PMID 97468663 Проверьте параметр
|pmid=(справка на английском). - ↑ Vortmeyer, AO; et al. (2000). “Somatic von Hippel-Lindau gene mutations detected in sporadic endolymphatic sac tumors”. Cancer Res. 60: 5963–5965. PMID 20535963.
- 1 2 Hoebeeck J, Vandesompele J, Nilsson H, De Preter K, Van Roy N, De Smet E, Yigit N, De Paepe A, Laureys G, Påhlman S, Speleman F (2006). “The von Hippel-Lindau tumor suppressor gene expression level has prognostic value in neuroblastoma”. Int J Cancer. 119 (3). PMID 16506218. Текст "624-629" пропущен (справка)
- ↑ Attiyeh EF, London WB, Mossé YP, Wang Q, Winter C, Khazi D, McGrady PW, Seeger RC, Look AT, Shimada H, Brodeur GM, Cohn SL, Matthay KK, Maris JM, "Chromosome 1p and 11q deletions and outcome in neuroblastoma.", The New England journal of medicine, PMID 16306521
- 1 2 3 http://194.167.35.168:2200/4DACTION/W_DEL_M
- ↑ Woodward, ER; et al. (1997). “Genetic predisposition to phaeochromocytoma: analysis of candidate genes GDNF, RET and VHL”. Hum Mol Genet. 6: 1051–1056. PMID 97358578 Проверьте параметр
|pmid=(справка на английском). - ↑ Crossey, PA, Eng, C, Ginalska-Malinowska, M, Lennard, TW, Wheeler, DC, Ponder, BA, Maher, ER (1995). “Molecular genetic diagnosis of von Hippel-Lindau disease in familial phaeochromocytoma”. J Med Genet. 32: 885–886. PMID 8592333.
- ↑ Neumann, HP, Bausch, B, McWhinney, SR, Bender, BU, Gimm, O, Franke, G, Schipper, J, Klisch, J, Altehoefer, C, Zerres, K, Januszewicz, A, Eng, C (2002). “Germ-line mutations in nonsyndromic pheochromocytoma”. New Eng J Med. 346: 1459–1466. PMID 12000816.
- 1 2 3 4 Pastore, Y, Jedlickova, K, Guan, Y, Liu, E, Fahner, J, Hasle, H, Prchal, JF, Prchal, JT (2003). “Mutations of von Hippel-Lindau tumor-suppressor gene and congenital polycythemia”. Am J Hum Genet. 73: 412–419. PMID 12844285.
- 1 2 Kanno, H, Kondo, K, Ito, S, Yamamoto, I, Fujii, S, Torigoe, S, Sakai, N, Hosaka, M, Shuin, T, Yao, M (1994). “Somatic mutations of the von Hippel-Lindau tumor suppressor gene in sporadic central nervous system hemangioblastomas”. Cancer Res (54): 4845–4847. PMID 8069849.
- ↑ Мутация семьи МакКоу.
- ↑ Gilcrease, MZ, Schmidt, L, Zbar, B, Truong, L, Rutledge, M, Wheeler, TM (1995). “Somatic von Hippel-Lindau mutation in clear cell papillary cystadenoma of the epididymis”. Hum Path (26): 1341–1346. PMID 8522307.
- ↑ Brauch, H, Kishida, T, Glavac, D, Chen, F, Pausch, F, Hofler, H, Latif, F, Lerman, MI, Zbar, B, Neumann, HPH (1995). “Von Hippel-Lindau (VHL) disease with pheochromocytoma in the Black Forest region of Germany: evidence for a founder effect”. Hum Genet (95): 551–556. PMID 7759077.
- ↑ Bender, BU, Eng, C, Olschewski, M, Berger, DP, Laubenberger, J, Altehofer, C, Kirste, G, Orszagh, M, van Velthoven, V, Miosczka, H, Schmidt, D, Neumann, HPH (2001). “VHL c.505 T-C mutation confers a high age related penetrance but no increased overall mortality”. J Med Genet (38): 508–514. PMID 11483638.
- ↑ Neumann, HP; et al. (1995). “Consequences of direct genetic testing for germline mutations in the clinical management of families with multiple endocrine neoplasia, type II”. JAMA. 274, : 1149–1151. PMID 96011708 Проверьте параметр
|pmid=(справка на английском). - ↑ Ritter, MM; et al. (1996). “Isolated familial pheochromocytoma as a variant of von Hippel-Lindau disease”. J Clin Endocrinol Metab. 81: 1035–1037. PMID 96368564 Проверьте параметр
|pmid=(справка на английском). - ↑ Ang, SO, Chen, H, Gordeuk, VR, Sergueeva, AI, Polyakova, LA, Miasnikova, GY, Kralovics, R, Stockton, DW, Prchal, JT (2002). “Endemic polycythemia in Russia: mutation in the VHL gene”. Blood Cell Molec Dis. 28: 57–62.
- 1 2 3 Menon S, Tsuge T, Dohmae N, Takio K, Wei N (2008). “Association of SAP130/SF3b-3 with Cullin-RING ubiquitin ligase complexes and its regulation by the COP9 signalosome”. BMC Biochemistry. 9: 1. DOI:10.1186/1471-2091-9-1. PMC 2265268. PMID 18173839.
- 1 2 3 Ewing RM, Chu P, Elisma F, Li H, Taylor P, Climie S, McBroom-Cerajewski L, Robinson MD, O'Connor L, Li M, Taylor R, Dharsee M, Ho Y, Heilbut A, Moore L, Zhang S, Ornatsky O, Bukhman YV, Ethier M, Sheng Y, Vasilescu J, Abu-Farha M, Lambert JP, Duewel HS, Stewart II, Kuehl B, Hogue K, Colwill K, Gladwish K, Muskat B, Kinach R, Adams SL, Moran MF, Morin GB, Topaloglou T, Figeys D (2007). “Large-scale mapping of human protein-protein interactions by mass spectrometry”. Molecular Systems Biology. 3: 89. DOI:10.1038/msb4100134. PMC 1847948. PMID 17353931.
- 1 2 3 Ohh M, Takagi Y, Aso T, Stebbins CE, Pavletich NP, Zbar B, Conaway RC, Conaway JW, Kaelin WG (December 1999). “Synthetic peptides define critical contacts between elongin C, elongin B, and the von Hippel–Lindau protein”. The Journal of Clinical Investigation. 104 (11): 1583—91. DOI:10.1172/JCI8161. PMC 481054. PMID 10587522.
- 1 2 3 Hacker KE, Lee CM, Rathmell WK. Zhang, Baohong, ed. “VHL type 2B mutations retain VBC complex form and function”. PloS One. 3 (11): e3801. DOI:10.1371/journal.pone.0003801. PMC 2583047. PMID 19030229.
- ↑ Kamura T, Burian D, Yan Q, Schmidt SL, Lane WS, Querido E, Branton PE, Shilatifard A, Conaway RC, Conaway JW (August 2001). “Muf1, a novel Elongin BC-interacting leucine-rich repeat protein that can assemble with Cul5 and Rbx1 to reconstitute a ubiquitin ligase”. The Journal of Biological Chemistry. 276 (32): 29748—53. DOI:10.1074/jbc.M103093200. PMID 11384984.
- 1 2 Zhou MI, Wang H, Ross JJ, Kuzmin I, Xu C, Cohen HT (October 2002). “The von Hippel–Lindau tumor suppressor stabilizes novel plant homeodomain protein Jade-1”. The Journal of Biological Chemistry. 277 (42): 39887—98. DOI:10.1074/jbc.M205040200. PMID 12169691.
- 1 2 Tsuchiya H, Iseda T, Hino O (July 1996). “Identification of a novel protein (VBP-1) binding to the von Hippel–Lindau (VHL) tumor suppressor gene product”. Cancer Research. 56 (13): 2881—5. PMID 8674032.
- 1 2 Mahon PC, Hirota K, Semenza GL (October 2001). “FIH-1: a novel protein that interacts with HIF-1alpha and VHL to mediate repression of HIF-1 transcriptional activity”. Genes & Development. 15 (20): 2675—86. DOI:10.1101/gad.924501. PMC 312814. PMID 11641274.
- 1 2 3 Kim BY, Kim H, Cho EJ, Youn HD (February 2008). “Nur77 upregulates HIF-alpha by inhibiting pVHL-mediated degradation”. Experimental & Molecular Medicine. 40 (1): 71—83. DOI:10.3858/emm.2008.40.1.71. PMC 2679322. PMID 18305400.
- 1 2 3 Min JH, Yang H, Ivan M, Gertler F, Kaelin WG, Pavletich NP (June 2002). “Structure of an HIF-1alpha -pVHL complex: hydroxyproline recognition in signaling”. Science. 296 (5574): 1886—9. DOI:10.1126/science.1073440. PMID 12004076.
- 1 2 Corn PG, McDonald ER, Herman JG, El-Deiry WS (November 2003). “Tat-binding protein-1, a component of the 26S proteasome, contributes to the E3 ubiquitin ligase function of the von Hippel–Lindau protein”. Nature Genetics. 35 (3): 229—37. DOI:10.1038/ng1254. PMID 14556007.
- ↑ Li Z, Wang D, Na X, Schoen SR, Messing EM, Wu G (April 2003). “The VHL protein recruits a novel KRAB-A domain protein to repress HIF-1alpha transcriptional activity”. The EMBO Journal. 22 (8): 1857—67. DOI:10.1093/emboj/cdg173. PMC 154465. PMID 12682018.
- ↑ Tanimoto K, Makino Y, Pereira T, Poellinger L (August 2000). “Mechanism of regulation of the hypoxia-inducible factor-1 alpha by the von Hippel–Lindau tumor suppressor protein”. The EMBO Journal. 19 (16): 4298—309. DOI:10.1093/emboj/19.16.4298. PMC 302039. PMID 10944113.
- ↑ Yu F, White SB, Zhao Q, Lee FS (August 2001). “HIF-1alpha binding to VHL is regulated by stimulus-sensitive proline hydroxylation”. Proceedings of the National Academy of Sciences of the United States of America. 98 (17): 9630—5. DOI:10.1073/pnas.181341498. PMC 55503. PMID 11504942.
- ↑ Jung JE, Kim HS, Lee CS, Shin YJ, Kim YN, Kang GH, Kim TY, Juhnn YS, Kim SJ, Park JW, Ye SK, Chung MH (October 2008). “STAT3 inhibits the degradation of HIF-1alpha by pVHL-mediated ubiquitination”. Experimental & Molecular Medicine. 40 (5): 479—85. DOI:10.3858/emm.2008.40.5.479. PMC 2679355. PMID 18985005.
- ↑ André H, Pereira TS (October 2008). “Identification of an alternative mechanism of degradation of the hypoxia-inducible factor-1alpha”. The Journal of Biological Chemistry. 283 (43): 29375—84. DOI:10.1074/jbc.M805919200. PMC 2662024. PMID 18694926.
- ↑ Park YK, Ahn DR, Oh M, Lee T, Yang EG, Son M, Park H (July 2008). “Nitric oxide donor, (+/-)-S-nitroso-N-acetylpenicillamine, stabilizes transactive hypoxia-inducible factor-1alpha by inhibiting von Hippel–Lindau recruitment and asparagine hydroxylation”. Molecular Pharmacology. 74 (1): 236—45. DOI:10.1124/mol.108.045278. PMID 18426857.
- 1 2 Li Z, Na X, Wang D, Schoen SR, Messing EM, Wu G (February 2002). “Ubiquitination of a novel deubiquitinating enzyme requires direct binding to von Hippel–Lindau tumor suppressor protein”. The Journal of Biological Chemistry. 277 (7): 4656—62. DOI:10.1074/jbc.M108269200. PMID 11739384.
Для углубленного изучения
- Conaway RC, Conaway JW (2003). “The von Hippel–Lindau tumor suppressor complex and regulation of hypoxia-inducible transcription”. Advances in Cancer Research. 85: 1—12. DOI:10.1016/S0065-230X(02)85001-1. PMID 12374282.
- Czyzyk-Krzeska MF, Meller J (April 2004). “von Hippel–Lindau tumor suppressor: not only HIF's executioner”. Trends in Molecular Medicine. 10 (4): 146—9. DOI:10.1016/j.molmed.2004.02.004. PMID 15162797.
- Esteban MA, Harten SK, Tran MG, Maxwell PH (July 2006). “Formation of primary cilia in the renal epithelium is regulated by the von Hippel–Lindau tumor suppressor protein”. Journal of the American Society of Nephrology. 17 (7): 1801—6. DOI:10.1681/ASN.2006020181. PMID 16775032.
- Hoebeeck J, Vandesompele J, Nilsson H, De Preter K, Van Roy N, De Smet E, Yigit N, De Paepe A, Laureys G, Påhlman S, Speleman F (August 2006). “The von Hippel–Lindau tumor suppressor gene expression level has prognostic value in neuroblastoma”. International Journal of Cancer. 119 (3): 624—9. DOI:10.1002/ijc.21888. PMID 16506218.
- Kaelin WG (September 2004). “The von Hippel–Lindau tumor suppressor gene and kidney cancer”. Clinical Cancer Research. 10 (18 Pt 2): 6290S–5S. DOI:10.1158/1078-0432.CCR-sup-040025. PMID 15448019.
- Kaelin WG (January 2007). “The von Hippel–Lindau tumor suppressor protein and clear cell renal carcinoma”. Clinical Cancer Research. 13 (2 Pt 2): 680s–684s. DOI:10.1158/1078-0432.CCR-06-1865. PMID 17255293.
- Kamura T, Conaway JW, Conaway RC (2002). “Roles of SCF and VHL ubiquitin ligases in regulation of cell growth”. Progress in Molecular and Subcellular Biology. 29: 1—15. DOI:10.1007/978-3-642-56373-7_1. PMID 11908068.
- Kralovics R, Skoda RC (January 2005). “Molecular pathogenesis of Philadelphia chromosome negative myeloproliferative disorders”. Blood Reviews. 19 (1): 1—13. DOI:10.1016/j.blre.2004.02.002. PMID 15572213.
- Lonser RR, Glenn GM, Walther M, Chew EY, Libutti SK, Linehan WM, Oldfield EH (June 2003). “von Hippel–Lindau disease”. Lancet. 361 (9374): 2059—67. DOI:10.1016/S0140-6736(03)13643-4. PMID 12814730.
- Neumann HP, Wiestler OD (May 1991). “Clustering of features of von Hippel–Lindau syndrome: evidence for a complex genetic locus”. Lancet. 337 (8749): 1052—4. DOI:10.1016/0140-6736(91)91705-Y. PMID 1673491.
- Russell RC, Ohh M (January 2007). “The role of VHL in the regulation of E-cadherin: a new connection in an old pathway”. Cell Cycle. 6 (1): 56—9. DOI:10.4161/cc.6.1.3668. PMID 17245122.
- Schipani E (2006). “Hypoxia and HIF-1 alpha in chondrogenesis”. Seminars in Cell & Developmental Biology. 16 (4–5): 539—46. DOI:10.1016/j.semcdb.2005.03.003. PMID 16144691.
- Takahashi K, Iida K, Okimura Y, Takahashi Y, Naito J, Nishikawa S, Kadowaki S, Iguchi G, Kaji H, Chihara K (2006). “A novel mutation in the von Hippel–Lindau tumor suppressor gene identified in a Japanese family with pheochromocytoma and hepatic hemangioma”. Internal Medicine. 45 (5): 265—9. DOI:10.2169/internalmedicine.45.1547. PMID 16595991.
- Graff JW (2005). “The VHL Handbook: What You Need to Know about VHL”. VHL Family Alliance. 12 (1): 1—56.
Ссылки
- VHL Alliance
- The VHL mutations database
- Gen VHL на странице ExPASy Proteomics
- Ген VHL в базе Ensembl
- Ген VHL и его гомологи в базе HomoloGene
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .

