
Опио́идные реце́пторы (опиатные рецепторы) — разновидность рецепторов нервной системы, относящихся к рецепторам, сопряжённым с G-белком.[1][2][3] Основная их функция в организме — регулирование болевых ощущений. В настоящее время различают четыре основные группы опиоидных рецепторов: μ- (мю), δ- (дельта), κ- (каппа) и ноцицептиновые (ORL1) рецепторы. Они связываются как с эндогенными (вырабатываемые в организме), так и с экзогенными (поступающими извне) опиоидными лигандами. Опиатные рецепторы широко распространены в головном, спинном мозге, а также в желудочно-кишечном тракте и других органах.
История
К середине 1960-х годов, анализируя результаты фармакологических исследований, учёные стали предполагать, что опиоиды, вероятно, действуют на специфические рецепторы.[4] Рецепторы были впервые определены как специфические молекулы при проведении исследований, в которых было обнаружено, что опиаты, меченные радиоизотопами, связываются с субклеточными фракциями головного мозга. Первое такое исследование было опубликовано в 1971 году с использованием 3H-леворфанола и его антагониста налоксона.[5] В 1973 году Кэндис Перт и Соломон Снайдер опубликовали результаты первого подробного радиоизотопного исследования опиоидных рецепторов с использованием 3H-налоксона.[6] Это исследование было признано как первое точное обнаружение опиоидных рецепторов, хотя вскоре после него в этом же году были проведены два других подобных исследования.[7][8] В 1976 году Мартин и коллеги по результатам исследований in vivo на собаках пришли к выводам о существовании нескольких типов опиоидных рецепторов.[9] Для подтверждения их существования предпринимались попытки выделения очищенного белка опиоидных рецепторов,[10][11] но они были безуспешными.[12] В начале 1990-х годов в молекулярно-биологических исследованиях выяснили структуру и механизм действия опиоидных рецепторов. Четыре различные кДНК были выделены как представители семейства опиоидных рецепторов.[13] Три из них соответствуют µ-, δ- и κ-рецепторам, а четвёртая — новому типу рецепторов — ноцицептивным или ORL-1 (англ. opioid-receptor-like 1), который отнесён также к опиоидным, хотя он не обладает высоким сродством с опиоидными лигандами.[14]:198
Механизм действия
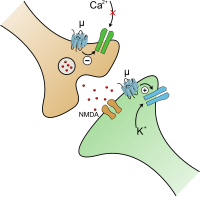
При активации опиоидного рецептора ингибируется аденилатциклаза, которая играет важную роль при синтезе вторичного посредника цАМФ (cAMP), а также осуществляется регулирование ионных каналов. Закрытие потенциал-зависимых кальциевых каналов в пресинаптическом нейроне приводит к уменьшению выброса возбуждающих нейромедиаторов (таких как глутаминовая кислота), а активация калиевых каналов в постсинаптическом нейроне приводит к гиперполяризации мембраны, что уменьшает чувствительность нейрона к возбуждающим нейромедиаторам[15][16].
Виды опиоидных рецепторов
В настоящее время различают четыре основные группы опиоидных рецепторов, каждая из которых подразделяется ещё на несколько подтипов:[17]
| Рецептор | Подтип | Расположение [18][19] | Функция [18][19] |
|---|---|---|---|
| мю (μ) MOP | μ1, μ2, μ3 |
|
μ1:
μ2:
μ3:
|
| дельта (δ) DOP | δ1, δ2 |
|
|
| каппа (κ) KOP | κ1, κ2, κ3 |
|
|
| Ноцицептиновый рецептор NOP (ORL1) | - |
|
|
Эффект анальгезии наблюдается при стимуляции μ-, δ- и κ-рецепторов. Агонисты μ-рецепторов, кроме того, вызывают угнетение дыхания и седативный эффект, а агонисты κ-рецепторов — психотомиметические эффекты. Действие большинства опиоидных анальгетиков связано со стимуляцией рецепторов μ-типа[20].
Номенклатура
Опиоидные рецепторы были названы по первой букве лиганда, с которым впервые обнаружена их связь. Так, морфин был первым веществом, у которого была обнаружена способность связываться с μ-рецепторами, а κ-рецепторы названы в честь обнаружения их связывания с кетоциклазоцином.[21] Также рецептор с высоким сродством к энкефалинам был обнаружен в семявыносящих протоках мышей и назван δ-рецептором.[22] Позднее другой опиоидный рецептор был обнаружен и клонирован на основе гомологичности с кДНК. Этот рецептор известен как ноцицептиновый рецептор или ORL 1-рецептор.
Предположено существование отдельных подтипов опиоидных рецепторов в тканях человека, однако исследователям пока не удалось получить генетических или молекулярных доказательств их существования и считают, что они возникают в результате посттрансляционной модификации клонированных типов рецепторов или димеризации.[23]
Подкомитет IUPHAR допускает применение общепринятой греческой классификации, но рекомендует 3 классических рецептора (μ-, δ-, κ-) и ноцицептиновый рецептор обозначать как MOP, DOP, KOP и NOP соответственно.[24][25]
Лиганды
Эндогенные
Эндогенные опиоидные пептиды вырабатываются в самом организме и реализуют свои опиоидные эффекты. Обнаружение опиоидных рецепторов привело к открытию их эндогенных лигандов. Вначале были обнаружены три семейства опиоидных пептидов (эндорфины, энкефалины и динорфины) в различных областях ЦНС, желудочно-кишечном тракте и других периферических тканях.[14]:200 Позднее были обнаружены ноцицептины, эндоморфины и другие опиоидные пептиды.[14]:200 При этом эндорфины, эндоморфины проявляют максимальное сродство к рецепторам типа μ, энкефалины — типа δ, динорфины — типа κ[20][26]:194
Экзогенные
Экзогенные опиоиды поступают в организм извне и связываются с опиоидными рецепторами. Первым открытым опиоидом был морфин, алкалоид опийного мака, выделенный Фридрихом Сертюрнером из опиума в 1804 г.[27] В настоящее время известно большое количество соединений (как производных морфина, так и веществ другой структуры), являющихся лигандами к опиоидным рецепторам. По происхождению различают естественные, синтетические и полусинтетические опиоиды.[12] Многие из них используются в медицине в качестве анальгетиков и средств против кашля.
Агонисты μ-опиоидных рецепторов обладают большим потенциалом злоупотребления, в краткосрочном периоде вызывая эйфорию, а при систематическом употреблении — сильную физическую и психическую зависимость. По этой причине оборот опиоидов в большинстве стран контролируется.
Некоторые экзогенные лиганды и их сродство к различным типам опиоидных рецепторов[28][29]:
| Вещество | Сродство к рецепторам | ||
|---|---|---|---|
| μ | δ | κ | |
| Морфин | + + | + | + |
| Героин*, Метадон, Фентанил | + + | ||
| Сальвинорин А | + | ||
| Кодеин, Оксикодон, Гидрокодон, Декстропропоксифен | ± | ||
| Буторфанол | − − | + + | |
| Пентазоцин | ± | + | |
| Бупренорфин | ± | − − | − − |
| Налорфин | − | + | |
| Нальбуфин | − − | + + | |
| Налоксон и Налтрексон | − − | − | − |
| Обозначения: ++: сильный агонист, +: агонист, ±: частичный агонист, −: антагонист, − −: сильный антагонист. | |||
*Сам героин обладает довольно слабым сродством к μ-рецепторам, но легко проникает через гемато-энцефалический барьер, где преобразуется в 6-моноацетилморфин — мощный агонист μ-рецепторов[30].
Другие рецепторы
σ-рецепторы ранее относили к опиоидным, так как считали, что противокашлевой эффект многих опиоидов реализуется через действие на эти рецепторы, а также первые селективные σ-агонисты были производными опиоидов (например, аллилнорметазоцин). Однако было обнаружено, что σ-рецепторы не активируются эндогенными опиоидными пептидами и сильно отличаются от других опиоидных рецепторов как по функции, так и по генетической структуре. Также они показали высокую чувствительность к фенциклидину и кетамину, которые являются специфическими антагонистами комплексу глутамат-N-метил-D-аспартат.[14]:198 Кроме того, они не подвергаются реверсии налоксоном и обладают стереоселективностью к правовращающим изомерам, а опиоидные рецепторы избирательны к левовращающим изомерам.[31]:125
Также предполагают существование других опиоидных рецепторов в связи с обнаружением эффектов эндогенных опиоидных пептидов, не опосредованных одним из четырёх известных опиоидных рецепторов.[32][33][34] Только один из таких рецепторов был обнаружен и назван дзета (ζ-) опиоидным рецептором, который проявил себя как модулятор фактора роста клеток при действии его эндогенного лиганда — мет-энкефалина. Этот рецептор в настоящее время чаще обозначают как опиоидный рецептор фактора роста (OGFr).[35][36]
Предполагают существование эпсилон (ε-) опиоидного рецептора. Такое предположение появилось после того, как у бета-эндорфина были обнаружены эффекты, которые не опосредованы каким-либо известным опиоидным рецептором.[37][38] Активация ε-рецептора вызывает выраженное обезболивание и выброс мет-энкефалина и было обнаружено, что ряд широко используемых опиоидных агонистов, таких как μ-агонист эторфин и κ-агонист бремазоцин, действуют как агонисты этих эффектов (даже в присутствии антагонистов к их более известным мишеням),[39] а бупренорфин действует как антагонист этого рецептора. В настоящее время доступны несколько селективных агонистов и антагонистов предполагаемых ε-рецепторов,[40][41] однако попытки обнаружить ген этих рецепторов были безуспешны.
Патология
Мутация A118G (замена аденина на гуанин в экзоне 1), которая приводит к замещению аспарагина в позиции 40 на аспартат (N40D) — наиболее частая мутация, приводящая к изменению генного продукта µ-опиоидного рецептора человека. Предполагают, что пациентам с онкологическими заболеваниями, гомозиготным по варианту A118G, требуется более высокая доза морфина при длительном лечении болевого синдрома.[42] Также внутривенное введение морфина, контролируемое пациентом, после тотальной гистерэктомии было значительно больше у женщин, гомозиготных по варианту A118G, чем у других пациенток.[43] Некоторые формы мутаций δ-опиоидных рецепторов приводят к постоянной активации рецептора.[44]
Примечания
- ↑ Dhawan BN, Cesselin F, Raghubir R, Reisine T, Bradley PB, Portoghese PS, Hamon M (December 1996). “International Union of Pharmacology. XII. Classification of opioid receptors”. Pharmacol. Rev. 48 (4): 567—92. PMID 8981566. Используется устаревший параметр
|month=(справка) - ↑ Janecka A, Fichna J, Janecki T (2004). “Opioid receptors and their ligands”. Curr Top Med Chem. 4 (1): 1—17. PMID 14754373.
- ↑ Waldhoer M, Bartlett SE, Whistler JL (2004). “Opioid receptors”. Annu. Rev. Biochem. 73: 953—90. DOI:10.1146/annurev.biochem.73.011303.073940. PMID 15189164.
- ↑ Martin WR (December 1967). “Opioid antagonists”. Pharmacol. Rev. 19 (4): 463—521. PMID 4867058. Используется устаревший параметр
|month=(справка) - ↑ Goldstein A, Lowney LI, Pal BK (August 1971). “Stereospecific and nonspecific interactions of the morphine congener levorphanol in subcellular fractions of mouse brain”. Proc. Natl. Acad. Sci. U.S.A. 68 (8): 1742—7. DOI:10.1073/pnas.68.8.1742. PMC 389284. PMID 5288759. Используется устаревший параметр
|month=(справка) - ↑ Pert CB, Snyder SH (March 1973). “Opiate receptor: demonstration in nervous tissue”. Science (journal). 179 (77): 1011—4. DOI:10.1126/science.179.4077.1011. PMID 4687585. Используется устаревший параметр
|month=(справка) - ↑ Terenius L (1973). “Stereospecific interaction between narcotic analgesics and a synaptic plasm a membrane fraction of rat cerebral cortex”. Acta Pharmacol. Toxicol. (Copenh.). 32 (3): 317—20. PMID 4801733.
- ↑ Simon EJ, Hiller JM, Edelman I (July 1973). “Stereospecific binding of the potent narcotic analgesic (3H) Etorphine to rat-brain homogenate”. Proc. Natl. Acad. Sci. U.S.A. 70 (7): 1947—9. DOI:10.1073/pnas.70.7.1947. PMC 433639. PMID 4516196. Используется устаревший параметр
|month=(справка) - ↑ Bjorn Knollmann; Laurence Brunton; Chabner, Bruce. Goodman and Gilman's Pharmacological Basis of Therapeutics, Twelfth Edition (SET2) (Pharmacologic Basis of Therapeutics (Goodman & Gilman)) Chapter 21. Opioid Analgesics. — McGraw-Hill Professional, 2010. — ISBN 0-07-162442-2.
- ↑ Caruso TP, AE Takemori, DL Larson, PS Portoghese (April 1979). “Chloroxymorphamine, an opioid receptor site-directed alkylating agent having narcotic agonist activity”. Science. 204 (4390): 316—8. DOI:10.1126/science.86208. PMID 86208. Используется устаревший параметр
|month=(справка) - ↑ Caruso TP, DL Larson, PS Portoghese, AE Takemori (December 1980). “Isolation of selective 3H-chlornaltrexamine-bound complexes, possible opioid receptor components in brains of mice”. Life Sciences. 27 (22): 2063—9. DOI:10.1016/0024-3205(80)90485-3. PMID 6259471. Используется устаревший параметр
|month=(справка) - 1 2 Ronald D. Miller MD, Lars I. Eriksson, Lee A. Fleisher MD, Jeanine P. Wiener-Kronish MD, William L. Young. Miller's Anesthesia. Глава "Opioids". — Churchill Livingstone, 2009. — 3312 с. — ISBN 978-0443069598.
- ↑ Minami M, Satoh M (September 1995). “Molecular biology of the opioid receptors: structures, functions and distributions”. Neurosci. Res. 23 (2): 121—45. PMID 8532211. Используется устаревший параметр
|month=(справка) - 1 2 3 4 Norton Williams; Norman Calvey. Principles and Practice of Pharmacology for Anaesthetists. — Wiley-Blackwell, 2008. — 357 с. — ISBN 978-0632056057.
- ↑ Alan F. Schatzberg,Charles B. Nemeroff. The American Psychiatric Publishing Textbook of Psychopharmacology. — The American Psychiatric Publishing, 2009. — С. 32. — 1648 с. — ISBN 9781585623099.
- ↑ Bertram G. Katzung. Basic & clinical pharmacology. 10th edition. — McGraw-Hill Medical, 2007. — С. 492. — 1200 с. — ISBN 0071604057.
- ↑ Corbett AD, Henderson G, McKnight AT, Paterson SJ (2006). “75 years of opioid research: the exciting but vain quest for the Holy Grail”. Br. J. Pharmacol. 147 Suppl 1: S153—62. DOI:10.1038/sj.bjp.0706435. PMC 1760732. PMID 16402099.
- 1 2 Stein C, Schäfer M, Machelska H (2003) Attacking pain at its source: new perspectives on opioids. Nature Med;9(8):1003-1008. doi:10.1038/nm908.
- 1 2 Fine, Perry G. Chapter 2: The Endogenous Opioid System // A Clinical Guide to Opioid Analgesia. — McGraw Hill, 2004.
- 1 2 Bertram G. Katzung. Basic & clinical pharmacology. 10th edition. — McGraw-Hill Medical, 2007. — С. 489-490. — 1200 с. — ISBN 0071604057.
- ↑ Anil Aggrawal. Opium: the king of narcotics. BLTC Research (1 мая 1995). Проверено 21 марта 2008. Архивировано 10 апреля 2012 года.
- ↑ Lord JA, Waterfield AA, Hughes J, Kosterlitz HW. Nature. 1977; 267:495-499.
- ↑ Lemke, Thomas L.; Williams, David H.; Foye, William O. Opioid Analgesics; Fries, DS // Foye's principles of medicinal chemistry. — Hagerstown, MD : Lippincott Williams & Wilkins, 2002. — ISBN 0-683-30737-1.
- ↑ Girdlestone, D. Opioid receptors; Cox BM, Chavkin C, Christie MJ, Civelli O, Evans C, Hamon MD, et al. // The IUPHAR Compendium of Receptor Characterization and Classification. — 2nd. — London : IUPHAR Media, 2000. — P. 321–333.
- ↑ «Opioid receptors». IUPHAR Database. International Union of Pharmacology (2008-08-01).
- ↑ Харкевич Д.А. Фармакология. — Москва: ГЭОТАР-Медиа, 2006. — 736 с. — ISBN 5-9704-0264-8.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — С. 313. — 414 с. — ISBN 978-3-906390-24-6.
- ↑ Bertram G. Katzung. Basic & clinical pharmacology. 11th edition. — McGraw-Hill Medical, 2009. — 1200 с. — ISBN 0071604057.
- ↑ Brian E. Leonard. Fundamentals of psychopharmacology. 3rd ed. — Wiley, 2003. — С. 393. — 527 с. — ISBN 0471521787.
- ↑ David A. Williams, William O. Foye, Thomas L. Lemke. Foye's principles of medicinal chemistry. — Lippincott, 2002. — С. 463. — 1114 с. — ISBN 0683307374.
- ↑ Бунятян, Мизиков. Рациональная фармакоанестезиология. — Москва: Литтерра, 2003. — 795 с. — 7000 экз. — ISBN 5-98216-040-7.
- ↑ Grevel J, Yu V, Sadée W (May 1985). “Characterization of a labile naloxone binding site (lambda site) in rat brain”. J. Neurochem. 44 (5): 1647—56. DOI:10.1111/j.1471-4159.1985.tb08808.x. PMID 2985759. Используется устаревший параметр
|month=(справка) - ↑ Mizoguchi H, Narita M, Nagase H, Tseng LF (October 2000). “Activation of G-proteins in the mouse pons/medulla by beta-endorphin is mediated by the stimulation of mu- and putative epsilon-receptors”. Life Sci. 67 (22): 2733—43. DOI:10.1016/S0024-3205(00)00852-3. PMID 11105989. Используется устаревший параметр
|month=(справка) - ↑ Wollemann M, Benyhe S (June 2004). “Non-opioid actions of opioid peptides”. Life Sci. 75 (3): 257—70. DOI:10.1016/j.lfs.2003.12.005. PMID 15135648. Используется устаревший параметр
|month=(справка) - ↑ Zagon IS, Verderame MF, Allen SS, McLaughlin PJ (February 2000). “Cloning, sequencing, chromosomal location, and function of cDNAs encoding an opioid growth factor receptor (OGFr) in humans”. Brain Res. 856 (1–2): 75—83. DOI:10.1016/S0006-8993(99)02330-6. PMID 10677613. Используется устаревший параметр
|month=(справка) - ↑ Zagon IS, Verderame MF, McLaughlin PJ (February 2002). “The biology of the opioid growth factor receptor (OGFr)”. Brain Res. Brain Res. Rev. 38 (3): 351—76. DOI:10.1016/S0165-0173(01)00160-6. PMID 11890982. Используется устаревший параметр
|month=(справка) - ↑ Wüster M, Schulz R, Herz A (December 1979). “Specificity of opioids towards the mu-, delta- and epsilon-opiate receptors”. Neurosci. Lett. 15 (2–3): 193—8. DOI:10.1016/0304-3940(79)96112-3. PMID 231238. Используется устаревший параметр
|month=(справка) - ↑ Schulz R, Wüster M, Herz A (March 1981). “Pharmacological characterization of the epsilon-opiate receptor”. J. Pharmacol. Exp. Ther. 216 (3): 604—6. PMID 6259326. Используется устаревший параметр
|month=(справка) - ↑ Narita M, Tseng LF (March 1998). “Evidence for the existence of the beta-endorphin-sensitive "epsilon-opioid receptor" in the brain: the mechanisms of epsilon-mediated antinociception”. Jpn. J. Pharmacol. ( (недоступная ссылка) – Scholar search)
|format=требует|url=(справка на английском). 76 (3): 233—53. DOI:10.1254/jjp.76.233. PMID 9593217. Используется устаревший параметр|month=(справка) - ↑ Fujii H, Narita M, Mizoguchi H, Murachi M, Tanaka T, Kawai K, Tseng LF, Nagase H (August 2004). “Drug design and synthesis of epsilon opioid receptor agonist: 17-(cyclopropylmethyl)-4,5alpha-epoxy-3,6beta-dihydroxy-6,14-endoethenomorphinan-7alpha-(N-methyl-N-phenethyl)carboxamide (TAN-821) inducing antinociception mediated by putative epsilon opioid receptor”. Bioorg. Med. Chem. 12 (15): 4133—45. DOI:10.1016/j.bmc.2004.05.024. PMID 15246090. Используется устаревший параметр
|month=(справка) - ↑ Fujii H, Nagase H (2006). “Rational drug design of selective epsilon opioid receptor agonist TAN-821 and antagonist TAN-1014”. Curr. Med. Chem. 13 (10): 1109—18. DOI:10.2174/092986706776360851. PMID 16719773.
- ↑ Klepstad P, Rakvåg TT, Kaasa S; et al. (November 2004). “The 118 A > G polymorphism in the human mu-opioid receptor gene may increase morphine requirements in patients with pain caused by malignant disease”. Acta Anaesthesiol Scand. 48 (10): 1232—9. DOI:10.1111/j.1399-6576.2004.00517.x. PMID 15504181. Используется устаревший параметр
|month=(справка) - ↑ Chou WY, Wang CH, Liu PH, Liu CC, Tseng CC, Jawan B (August 2006). “Human opioid receptor A118G polymorphism affects intravenous patient-controlled analgesia morphine consumption after total abdominal hysterectomy”. Anesthesiology. 105 (2): 334—7. PMID 16871067. Используется устаревший параметр
|month=(справка) - ↑ Befort K, Zilliox C, Filliol D, Yue S, Kieffer BL (June 1999). “Constitutive activation of the delta opioid receptor by mutations in transmembrane domains III and VII”. J. Biol. Chem. 274 (26): 18574—81. DOI:10.1074/jbc.274.26.18574. PMID 10373467. Используется устаревший параметр
|month=(справка)
Литература
- Alan F. Schatzberg,Charles B. Nemeroff. The American Psychiatric Publishing Textbook of Psychopharmacology. — The American Psychiatric Publishing, 2009. — 1648 с. — ISBN 9781585623099.
- Bertram G. Katzung. Basic & clinical pharmacology. — McGraw-Hill Medical, 2009. — 1200 с. — ISBN 0071604057. (недоступная ссылка)
- Brian E. Leonard. Fundamentals of psychopharmacology. 3rd ed. — Wiley, 2003. — 527 с. — ISBN 0471521787.
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .