| Гистидиндекарбоксилаза | |
|---|---|
| [[Файл:HDC 3d Ray Image.png|]] Cartoon depiction of C-truncated HDC dimer with PLP residing in active site. | |
| Идентификаторы | |
| Шифр КФ | 4.1.1.22 |
| Номер CAS | 9024-61-7 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 9024-61-7 |
Гистидиндекарбоксилаза (сокр. ГДК, HDC, КФ 4.1.1.22) — декарбоксилирующий фермент из класса лиаз, катализирующий процесс декарбоксилирования молекулы протеиногенной аминокислоты гистидина по реакции:

с образованием гистамина и углекислого газа соответственно. У млекопитающих гистамин является важным биогенным амином с регуляторной ролью в нейротрансмиссии, секреции соляной кислоты желудка и иммунном ответе[1].
В качестве кофермента ГДК использует пиридоксальфосфат (PLP)— кофактор, сходный со многими декарбоксилазами аминокислот[2][3].
Гистидиндекарбоксилаза является единственным участником пути синтеза гистамина, происходящего в одностадийной реакции. Гистамин не может быть получен каким-либо другим известным ферментом[4].
Эукариоты, а также грамотрицательные бактерии имеют общую HDC, в то время как грамположительные бактерии используют эволюционно несвязанные пирувоилзависимые HDC[5].
У человека ГДК кодируется геном HDC, локализованном на длинном плече (q-плече) 15-ой хромосомы[6][7].
Структура

Гистидиндекарбоксилаза представляет собой пиридоксальзависимую декарбоксилазу группы II вместе с декарбоксилазой ароматических аминокислот и тирозиндекарбоксилазой. HDC экспрессируется в виде 74 кДа полипептида, который не является ферментативно функциональным[8][9]. Только после посттрансляционной модификации фермент становится активным. Эта модификация состоит из усечения бóльшей части С-концевой цепи белка, уменьшая молекулярную массу пептида до 54 кДа.
Гистидиндекарбоксилаза существует как гомодимер с несколькими аминокислотами из соответствующей противоположной цепи, стабилизирующей активный сайт HDC. В состоянии покоя HDC пиридоксальфосфат ковалентно связывается как основание Шиффа с лизином 305 и стабилизируется несколькими водородными связями с соседними аминокислотами — аспартатом 273, серином 151 и серином 354 противоположной цепи[8]. HDC содержит несколько областей, которые последовательно и структурно подобны тем, которые присутствуют в ряде других пиридоксальзависимых декарбоксилаз[10]. Это особенно заметно вблизи остатка активного лизина 305[11].
Механизм катализа
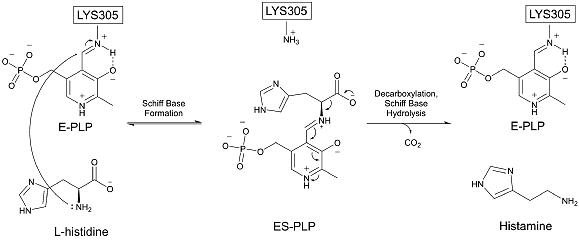
HDC декарбоксилирует гистидин с использованием кофактора PLP, первоначально связанного как основание Шиффа, с лизином 305[12].
Гистидин инициирует реакцию, вытесняя лизин 305 и образуя альдимин с PLP. Затем карбоксильная группа гистидина покидает молекулу, образуя углекислый газ. Наконец, PLP повторно образует свою исходное основание Шиффа в лизине 305, и гистамин высвобождается. Этот механизм очень похож на тот, который используется другими пиридоксальзависимыми декарбоксилазами. В частности, альдимин-промежуточное соединение является общей чертой всех известных PLP-зависимых декарбоксилаз[13]. HDC является высокоспецифичной для её гистидинового субстрата[14].
Биологическое значение
Гистидиндекарбоксилаза является основным биологическим источником гистамина. Гистамин является важным биогенным амином, который замедляет многочисленные физиологические процессы. Существует четыре разных рецептора гистамина: H1, H2, H3 и H4[4], каждый из которых несёт различное биологическое значение. H1 модулирует несколько функций центральной и периферической нервной системы, включая суточный ритм, температуру тела и аппетит[15]. Активация H2 рецептора приводит к секреции желудочной кислоты и релаксации гладких мышц[16][17]. H3 контролирует оборот гистамина путем ингибирования синтеза гистамина и его высвобождения[18]. Наконец, H4 играет роль в хемотаксисе тучных клеток и производстве цитокинов[15].
У людей HDC в основном экспрессируется в тучных клетках и базофильных гранулоцитах. Соответственно, эти клетки содержат самые высокие концентрации гистаминовых гранул в организме. Гистамин тучных клеток обнаружен также в головном мозге, где он используется в качестве нейротрансмиттера[19].
Клиническое значение
Антигистаминные препараты — это класс препаратов, предназначенных для снижения нежелательных эффектов вызванных избыточной секрецией гистамина в организме. Типичные антигистамины блокируют специфические рецепторы гистамина, в зависимости от того, какую физиологическую цель они выполняют[20]. Например, дифенгидрамин, нацелен и ингибирует Н1-рецептор гистамина, и как следствие происходит облегчение симптомов аллергических реакций. Ингибиторы гистидиндекарбоксилазы могут быть предположительно использованы в качестве нетипичных антигистаминов. Было показано, что тритокуалин, а также различные катехины, такие как эпигаллокатехин-3-галлат, основной компонент зелёного чая, нацелены на HDC и гистамин-секретируемые клетки (тучные клетки, базофилы, эозинофилы и др.), снижая уровни гистамина и обеспечивая противовоспалительные, противоопухолевые и антиангиогенные эффекты[21].
Мутации в гене для гистидиндекарбоксилазы наблюдались в одном семействе с синдромом Туретта (TS) и, как полагают, не учитываются в большинстве случаев TS[22].
Примечания
- ↑ Epps HM (1945). “Studies on bacterial amino-acid decarboxylases: 4. l(-)-histidine decarboxylase from Cl. welchii Type A”. Biochem. J. 39 (1): 42—6. PMC 1258146. PMID 16747851.
- ↑ Riley WD, Snell EE (October 1968). “Histidine decarboxylase of Lactobacillus 30a. IV. The presence of covalently bound pyruvate as the prosthetic group”. Biochemistry. 7 (10): 3520—8. DOI:10.1021/bi00850a029. PMID 5681461.
- ↑ Rosenthaler J, Guirard BM, Chang GW, Snell EE (July 1965). “Purification and properties of histidine decarboxylase from Lactobacillus 30a”. Proc. Natl. Acad. Sci. U.S.A. 54 (1): 152—8. DOI:10.1073/pnas.54.1.152. PMC 285813. PMID 5216347.
- 1 2 Shahid, Mohammad (2009). “Histamine, Histamine Receptors, and their Role in Immunomodulation: An Updated Systematic Review” (PDF). The Open Immunology Journal. 2: 9—41.
- ↑ Kimura, B.; Takahashi, H.; Hokimoto, S.; Tanaka, Y.; Fujii, T. (2009-08-01). “Induction of the histidine decarboxylase genes of Photobacterium damselae subsp. damselae (formally P. histaminum) at low pH”. Journal of Applied Microbiology [англ.]. 107 (2): 485—497. DOI:10.1111/j.1365-2672.2009.04223.x. ISSN 1365-2672.
- ↑ Entrez Gene: histidine decarboxylase.
- ↑ Bruneau G, Nguyen VC, Gros F, Bernheim A, Thibault J (November 1992). “Preparation of a rat brain histidine decarboxylase (HDC) cDNA probe by PCR and assignment of the human HDC gene to chromosome 15”. Hum. Genet. 90 (3): 235—8. DOI:10.1007/bf00220068. PMID 1487235.
- 1 2 3 Komori, Hirofumi; Nitta, Yoko; Ueno, Hiroshi; Higuchi, Yoshiki (2012-08-17). “Structural Study Reveals That Ser-354 Determines Substrate Specificity on Human Histidine Decarboxylase”. Journal of Biological Chemistry [англ.]. 287 (34): 29175—29183. DOI:10.1074/jbc.M112.381897. ISSN 0021-9258. PMC 3436558. PMID 22767596.
- ↑ Nitta, Yoko (2010). “Expression of recombinant human histidine decarboxylase with full length and C-terminal truncated forms in yeast and bacterial cells” (PDF). J. Biol. Macromol. 10.
- ↑ Jackson, F. Rob (1990-10-01). “Prokaryotic and eukaryotic pyridoxal-dependent decarboxylases are homologous”. Journal of Molecular Evolution [англ.]. 31 (4): 325—329. DOI:10.1007/BF02101126. ISSN 0022-2844.
- ↑ Sandmeier, Erika; Hale, Terence I.; Christen, Philipp (1994-05-01). “Multiple evolutionary origin of pyridoxal-5′-phosphate-dependent amino acid decarboxylases”. European Journal of Biochemistry [англ.]. 221 (3): 997—1002. DOI:10.1111/j.1432-1033.1994.tb18816.x. ISSN 1432-1033.
- 1 2 Wu, Fang; Yu, Jing; Gehring, Heinz (2008-03-01). “Inhibitory and structural studies of novel coenzyme-substrate analogs of human histidine decarboxylase”. The FASEB Journal [англ.]. 22 (3): 890—897. DOI:10.1096/fj.07-9566com. ISSN 0892-6638. PMID 17965265.
- ↑ Pyridoxal phosphate-dependent decarboxylase. InterPro.
- ↑ Toney, Michael D. (2005-01-01). “Reaction specificity in pyridoxal phosphate enzymes”. Archives of Biochemistry and Biophysics. Highlight issue on Enzyme Mechanisms. 433 (1): 279—287. DOI:10.1016/j.abb.2004.09.037.
- 1 2 Panula, Pertti; Chazot, Paul L.; Cowart, Marlon; Gutzmer, Ralf; Leurs, Rob; Liu, Wai L. S.; Stark, Holger; Thurmond, Robin L.; Haas, Helmut L. (2015-07-01). “International Union of Basic and Clinical Pharmacology. XCVIII. Histamine Receptors”. Pharmacological Reviews. 67 (3): 601—655. DOI:10.1124/pr.114.010249. ISSN 1521-0081. PMC 4485016. PMID 26084539.
- ↑ Canonica, G. Walter; Blaiss, Michael (2011-02-23). “Antihistaminic, Anti-Inflammatory, and Antiallergic Properties of the Nonsedating Second-Generation Antihistamine Desloratadine: a Review of the Evidence”. World Allergy Organization Journal [англ.]. 4 (2): 47. DOI:10.1097/WOX.0b013e3182093e19. ISSN 1939-4551. PMC 3500039. PMID 23268457.
- ↑ Hill, S.J. (1997). “Classification of Histamine Receptors”. Pharmacological Reviews. 49: 253—278 – via ASPET.
- ↑ West, R. E.; Zweig, A.; Shih, N. Y.; Siegel, M. I.; Egan, R. W.; Clark, M. A. (1990-11-01). “Identification of two H3-histamine receptor subtypes”. Molecular Pharmacology. 38 (5): 610—613. ISSN 0026-895X. PMID 2172771.
- ↑ Blandina, Patrizio; Provensi, Gustavo; Munari, Leonardo; Passani, Maria Beatrice (2012-01-01). “Histamine neurons in the tuberomamillary nucleus: a whole center or distinct subpopulations?”. Frontiers in Systems Neuroscience [англ.]. 6. DOI:10.3389/fnsys.2012.00033. ISSN 1662-5137. PMC 3343474. PMID 22586376.
- ↑ Diphenhydramine Hydrochloride. Drugs.com.
- ↑ Melgarejo, Esther; Medina, Miguel Ángel; Sánchez-Jiménez, Francisca; Urdiales, José Luis (2010-09-01). “Targeting of histamine producing cells by EGCG: a green dart against inflammation?”. Journal of Physiology and Biochemistry [англ.]. 66 (3): 265—270. DOI:10.1007/s13105-010-0033-7. ISSN 1138-7548.
- ↑ Online Mendelian Inheritance in Man: histidine decarboxylase.
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .