| Зоман | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
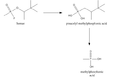
2-(Фторметилфосфорил)окси-3,3-диметилбутан |
| Сокращения | GD, EA 1210, PFMP |
| Традиционные названия | Пинаколиновый эфир фторангидрида метилфосфоновой кислоты |
| Хим. формула | C₇H₁₆FO₂P |
| Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 182,17 г/моль |
| Плотность | 1,0131[1] |
| Термические свойства | |
| Т. плав. | −80 °C |
| Т. кип. | около 190 °C (с разложением)[1] °C |
| Т. разл. | более 150[1] |
| Давление пара | 0,3 мм рт. ст. при +20 °C |
| Химические свойства | |
| Растворимость в воде | плохая |
| Растворимость в спирты, кетоны, сложные эфиры, алкилгалогениды | хорошая |
| Оптические свойства | |
| Показатель преломления | 1,4080 (D-линия натрия)[1] |
| Классификация | |
| Рег. номер CAS | 96-64-0 |
| PubChem | 7305 |
| SMILES | |
| InChI | |
| ChEBI | 9195 |
| ChemSpider | 7032 |
| Безопасность | |
| ПДК | 5·10-7 мг/м3 (в воздухе) |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Зома́н — фосфорорганическое вещество, бесцветная жидкость, имеющая, по разным данным, запах яблок, камфоры или слабый запах скошенного сена. Боевое отравляющее вещество нервно-паралитического действия. По многим свойствам очень похож на зарин, однако токсичнее его более чем в 2,5 раза. Стойкость зомана несколько выше, чем у зарина. Используется смесь четырёх стереоизомеров без разделения.
Синтез и свойства

Зоман является аналогом зарина, оба этих соединения являются сложными эфирами метилфторфосфоновой кислоты: зоман — пинаколиловым эфиром, зарин — изопропиловым. Химические свойства зомана аналогичны свойствам зарина, однако его реакционная способность по отношению к нуклеофилам понижена из-за стерических затруднений, создаваемых более объёмистым пинаколильным заместителем.
Зоман плохо растворим в воде (1,5 % при +25 °C), легко растворяется в спиртах и кетонах, а также в сложных эфирах и алкилгалогенидах. В кислых, нейтральных и слабощелочных средах гидролизуется медленно, наиболее медленный гидролиз наблюдается при pH = 4. Время гидролиза на 50 % при +30 °С и pH 2, 4 и 7 составляет соответственно 6,4, 250 и 41 час. При pH > 10 гидролизуется быстро; в 5 % NaOH реакция завершается через 5 минут, легко реагирует с растворами аммиака и аминов. При температуре >150 °C полностью разлагается, деструкция ускоряется в присутствии веществ кислотного характера. Температура кипения при атмосферном давлении около 190 °C, при давлении 0,1 мм рт. ст. 42 °C. Плотность 1,0131 г/см3 (при +20 °C). Коэффициент преломления 1,4080 (для жёлтого дублета натрия)[1].
Синтез зомана аналогичен синтезу зарина — его проводят этерификацией пинаколилового спирта (3,3-диметилбутан-2-ола) смесью дихлор- и дифторангидридов метилфосфоновой кислоты:
- CH3POCl2 + CH3POF2 + 2CH3CH(OH)C(CH3)3 2CH3P(=O)(F)OCH(CH3)C(CH3)3
Токсичность
Зоман является ингибитором холинэстеразы. Первые признаки поражения наблюдаются при концентрациях около 0,0005 мг/л через минуту (сужение зрачков глаз, затруднение дыхания). Среднесмертельная концентрация при действии через органы дыхания 0,03 мг·мин/л. Смертельная концентрация при резорбции через кожу — 2 мг/кг. Защита от зомана — противогаз и средства защиты кожи, а также антидоты. Впервые синтезирован в Германии Рихардом Куном в 1944 году для использования в качестве боевого отравляющего вещества.
Как антидоты можно применять атропин или пралидоксим, для снятия побочных симптомов (тревоги, эмоционального напряжения) можно использовать диазепам.
- Синтез агента GD
- Метаболизм зомана.
Примечания
- 1 2 3 4 5 Емельянов В. И. Зоман // Химическая энциклопедия: в 5 т / Кнунянц И. Л.. — М.: Советская энциклопедия, 1990. — Т. 2: Даффа—Меди. — С. 175. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5.
| Это заготовка статьи об органическом веществе. Вы можете помочь проекту, дополнив её. |
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .