| Зидовудин | |
|---|---|
| Zidovudine[1] | |
 | |
| Химическое соединение | |
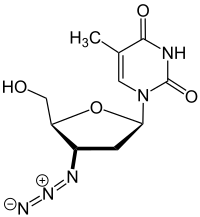
| ИЮПАК | 3'-Азидо-3'-дезокситимидин |
| Брутто-формула | C10H13N5O4 |
| Молярная масса | 267.242 |
| CAS | 30516-87-1 |
| PubChem | 35370 |
| DrugBank | DB00495 |
| Классификация | |
| Фармакол. группа | Средства для лечения ВИЧ-инфекции |
| АТХ | J05AF01 |
| МКБ-10 | B20., B21., B22., B23., B24. |
| Фармакокинетика | |
| Связывание с белками плазмы | 30—38 % |
| Метаболизм | Печень |
| Период полувывед. | от 0,5 до 3 часов |
| Экскреция | Почки |
| Лекарственные формы | |
| таблетки | |
| Способ введения | |
| перорально | |
| Другие названия | |
| Азидотимидин, Зидо-Эйч, Зидовирин, Зидовудин-Ферейн, Ретровир, Тимазид | |
Зидовудин (Zidovudine, ZDV), также известный как азидотимидин (AZT), — 3'-азидо-3'-дезокситимидин, противовирусный препарат, нуклеозидный ингибитор обратной транскриптазы вируса иммунодефицита человека. Первый антиретровирусный препарат: допущен к применению в марте 1987 года[2]. Применяется как самостоятельно, так и в составе комбинированных препаратов. Один из ключевых компонентов высокоактивной антиретровирусной терапии.
История
3'-Азидо-3'-дезокситимидин был впервые синтезирован в 1964 году Джеромом Хорвицем[en] (1919—2012) с сотрудниками в качестве потенциального противоопухолевого препарата[3][4]. Вследствие неактивности AZT в животных моделях исследования не получили дальнейшего развития[4].
Разработка противовирусных препаратов в Исследовательских лабораториях Веллкама[en] (ныне принадлежат GlaxoSmithKline) проводилась под руководством Гертруды Элайон[4] (1918—1999). Азидопроизводные тимидина были синтезированы в 1981 году по опубликованным ранее методикам[5] и использованы в качестве синтетических предшественников некоторых соединений, а также включены в скрининговые библиотеки[4]. При скрининге антибактериальной активности AZT была обнаружена эффективность в отношении некоторых грамотрицательных, но не грамположительных бактерий: AZT эффективно фосфорилируется тимидинкиназами эшерихий[en] до соответствующего трифосфата, эффективно терминирующего полимеризацию ДНК[4]. В испытаниях in vivo была продемонстрирована эффективность и безопасность AZT в качестве ингибитора бактериальных инфекций[4].
При скрининге противовирусной активности AZT не проявил активности против вирусов простого герпеса типов 1 и 2, вируса ветряной оспы, аденовируса типа 5, вируса гриппа A[en], респираторно-синцитиального вируса, риновируса B, вируса жёлтой лихорадки, вируса кори, коронавируса, ротавируса крупного рогатого скота, вируса осповакцины[en], вируса везикулярного стоматита[en], вируса лейкоза мышей L1210[en], цитомегаловируса человека. Незначительная активность наблюдалась в отношении вируса Эпштейна — Барр[4].
В связи с открытием в 1983 году вируса иммунодефицита человека в начале 1984 года в лабораториях Веллкама были запущены исследования по поиску препаратов для лечения вызываемого ВИЧ заболевания. Был адаптирован метод бляшек[en], первоначально разработанный для других ретровирусов, и в процессе скрининга ранее исследованных противовирусных препаратов и других аналогов нуклеозидов AZT оказался единственным соединением, полностью подавлявшим репродукцию вируса[4]. Публикация противовирусной активности AZT[6] послужила толчком к дальнейшему исследованию аналогов нуклеозидов[en] в качестве ингибиторов обратной транскриптазы, в то время как для самого зидовудина был разработан метод масштабирования синтеза и начаты клинические исследования[4].
Зидовудин — первый антиретровирусный препарат, допущенный к применению в 1987 году.
Зидовудин очень эффективен при применении в комбинации с другими антиретровирусными препаратами. В 1990-е годы комбинация зидовудина и ламивудина была одной из наиболее широко применяемых базовых комбинаций НИОТ в схемах АРТ. Зидовудин изучался в многочисленных клинических исследованиях, и по его применению накоплен наиболее обширный опыт по сравнению со всеми остальными препаратами (более 20 лет).
По вышеперечисленным причинам во многих рекомендациях и стандартах зидовудин был исключен из списка предпочтительных препаратов первого ряда для лечения пациентов, ранее не получавших АРТ. Другой важный недостаток этого препарата состоит в необходимости приема два раза в сутки, в то время как многие антиретровирусные препараты достаточно принимать один раз в сутки. Это исключает возможность включения зидовудина в схемы АРТ с однократным приемом препаратов в сутки. Однако зидовудин продолжает входить в некоторые схемы АРТ, схемы профилактики передачи ВИЧ от матери ребенку и схемы постконтактной профилактики, поскольку польза от его применения была доказана, особенно с учетом мутаций резистентности вируса. Например, штаммы с мутациями K65R или M184V гиперчувствительны к зидовудину. Дополнительными преимуществами зидовудина служат отсутствие токсического действия на ЦНС и хорошее проникновение через гематоэнцефалический барьер. Кроме того, можно отметить, что патент на производство зидовудина в США истек в 2005 г. Вскоре этот препарат, возможно, будет продаваться значительно дешевле[7].
Благодаря коммерческому успеху зидовудина последовал всплеск интереса к нуклеозидным ингибиторам обратной транскриптазы: были разработаны диданозин[en], залцитабин[en], ставудин, ламивудин, абакавир и эмтрицитабин[en][2].
- Диданозин
- Залцитабин
- Ставудин
- Ламивудин
- Абакавир
- Эмтрицитабин
Синтез
Ключевая стадия первого синтеза 3'-азидо-3'-дезокситимидина, осуществлённого Хорвицем с соавторами, состояла в нуклеофильном замещении мезилатной группы при 3'-атоме углерода сахарного остатка действием азида лития в диметилформамиде[3]. После удаления тритильной защиты было получено целевое соединение в виде бесцветных игольчатых кристаллов[3].
Аналогичная последовательность реакций лежит в основе синтеза AZT, разработанного Лином и Прусоффом[5], однако методики отдельных стадий были ими оптимизированы.
Механизм действия
Аналогично другим нуклеозидным ингибиторам обратной транскриптазы, после троекратного фосфорилирования зидовудинтрифосфат выступает в качестве терминатора цепи синтезируемой по матрице РНК ДНК[2]. Таким образом, зидовудин является пролекарством, поскольку сам по себе зидовудин обратную транскрипцию не ингибирует[6].
В экспериментах по ингибированию цитопатического действия ВИЧ был обнаружен выраженный протективный эффект зидовудина в концентрациях 5-10 мкМ, не подавляющих нормальное функционирование T-клеток и B-клеток[6]. При этом полное ингибирование обратной транскриптазы наблюдалось в концентрациях 0,5 мкМ и выше[6].
Фармакокинетика
Метаболизм
Физические свойства

Бесцветные кристаллы. Растворимость в воде при 25 °C составляет 20,1 мг/мл. Температура плавления 119−121 °C[3]. рН водного 10 % раствора — 6,5 — 6,6.
Дозировка
Дозировки и формы выпуска: капсулы 100 мг, 300 мг; раствор для приема внутрь (50 мг в 5 мл, флаконы по 200 мл.); раствор для инфузий (200 мг, флаконы по 20мл).
Стандартные дозы и режим приема: 600 мг/сутки, разделенные на два или три приема: три раза в день по две капсулы 100 мг, или два раза в день по 300 мг.
Лекарственные взаимодействия и побочные эффекты
Можно применять вне зависимости от приема пищи, но жирная пища может замедлять всасывание. Не совместим со ставудином, комбинация с рибавирином может быть неэффективной. Усиление токсичности в отношении костного мозга в комбинациях с ганцикловиром, винкристином, амфотерицином «B», цитостатиками и другими препаратами, угнетающими костный мозг. Парацетамол увеличивает риск развития нейтропении. Метадон значимо повышает концентрацию в плазме (30—40 %), что может увеличивать риск развития побочных эффектов азидотимидина.
В высоких дозах предположительно является мутагеном, канцерогеном.
Острая токсичность — LD50 (крыса, перорально) — 3500 мг/кг.
Наиболее значимые побочные эффекты: в начале терапии (6—8 недель) — головокружение, слабость, сниженный аппетит, тошнота, рвота. При длительном применении — анемия, кожный зуд, боли в мышцах.
Уже в очень ранних исследованиях, посвященных монотерапии зидовудином, было установлено, что зидовудин существенно повышает выживаемость, по крайней мере, при тяжёлом иммунодефиците. Тем не менее в ходе очень крупных ранних исследований (ACTG 016 и ACTG 019) не удалось доказать статистически значимое влияние зидовудина на выживаемость у пациентов с бессимптомным течением ВИЧ-инфекции, хотя в обоих случаях отмечалось существенное уменьшение риска прогрессирования ВИЧ-инфекции. Уже тогда стало ясно, что эффективность монотерапии зидовудином, скорее всего, не очень высока. Вскоре репутация зидовудина пострадала ещё больше: в исследовании Concorde было установлено, что лечение зидовудином не даёт отдалённого положительного эффекта. Кроме того, в первые годы зидовудин назначали в очень высоких дозах (1500 мг/сут), которые вызывали выраженное угнетение кроветворения. Но и сейчас, когда зидовудин применяется в более низких дозах (500—600 мг/сут), не следует недооценивать его токсическое действие на костный мозг; поэтому у пациентов, получающих зидовудин, следует в обязательном порядке следить за показателями клинического анализа крови. Длительный приём зидовудина почти всегда приводит к макроцитозу (увеличению среднего объёма эритроцита, по наличию которого можно в некоторой степени судить о соблюдении режима лечения[7].
В 2011 году Зидовудин подвергся критике после проведения исследования Gilead 934, в котором было установлено, что зидовудин существенно уступает по эффективности тенофовиру. В этом крупном рандомизированном исследовании пациентам, ранее не получавшим АРТ, назначали эфавиренз в комбинации либо с зидовудином и ламивудином, либо с тенофовиром и эмтрицитабином. В частности, у пациентов, получавших зидовудин, чаще развивалась тяжёлая анемия, которая служила основанием для отмены терапии в 5,5 % случаев. Через 144 недели доля пациентов с вирусной нагрузкой меньше 400 копий/мл в группе, получавшей зидовудин, была меньше, чем в группе, получавшей тенофовир (58 % по сравнению с 71 %). Такая разница была обусловлена в значительной степени тем, что в группе, получавшей зидовудин, больше пациентов досрочно выбыло из исследования из-за побочных эффектов (11 % по сравнению с 5 %). Помимо симптомов угнетения кроветворения (анемии и нейтропении), побочные эффекты, приводившие к отмене терапии, включали главным образом нарушения работы ЖКТ (например, тошноту), которые обычно развивались в первые недели после начала лечения. Кроме того, у пациентов, получавших зидовудин, наблюдалось значимое уменьшение толщины подкожной жировой клетчатки на конечностях[7].
Показания к применению
Ранние (с числом клеток T4 менее 500/мм3) и поздние стадии ВИЧ-инфекции, профилактика трансплацентарного ВИЧ-инфицирования плода.
Противопоказания
Гиперчувствительность, лейкопения (число нейтрофилов менее 750x109/л), анемия (гемоглобин ниже 70 г/л)[8].
Комбинированные препараты
В сентябре 1997 года был допущен к применению комбинированный препарат ламивудина и зидовудина, получивший торговое наименование Комбивир[2].
В ноябре 2000 года была допущена к применению комбинация абакавира, ламивудина и зидовудина, распространяемая под торговым наименованием Тризивир[2].
Источники
- ↑ Зидовудин. Энциклопедия лекарств и товаров аптечного ассортимента. РЛС Патент. — Инструкция, применение и формула.
- 1 2 3 4 5 De Clercq, Erik. Approved Antiviral Drugs over the Past 50 Years : [англ.] / Erik De Clercq, Guangdi Li // Clin. Microbiol. Rev. — 2016. — Vol. 29, no. 3 (1 July). — P. 695—747. — ISSN 1098-6618. — DOI:10.1128/CMR.00102-15. — PMID 27281742.
- 1 2 3 4 Horwitz, Jerome P. Nucleosides. V. The Monomesylates of 1-(2'-Deoxy-β-D-lyxofuranosyl)thymine : [англ.] / Jerome P. Horwitz, Jonathan Chua, Michael Noel // J. Org. Chem. — 1964. — Vol. 29, no. 7 (July). — P. 2076—2078. — ISSN 0022-3263. — DOI:10.1021/jo01030a546.
- 1 2 3 4 5 6 7 8 9 Pattishall, Katryn H. Discovery and Development of Zidovudine as the Cornerstone of Therapy to Control Human Immunodeficiency Virus Infection // The Search for Antiviral Drugs : Case Histories from Concept to Clinic : [англ.] / Julian Adams ; Vincent J. Merluzzi. — Boston, MA : Birkhäuser, 1993. — 2. — P. 23—43. — XIII, 240 p. — ISBN 978-1-4899-6720-6. — DOI:10.1007/978-1-4899-6718-3_2.
- 1 2 Lin, Tai-Shun. Synthesis and Biological Activity of Several Amino Analogues of Thymidine : [англ.] / Tai-Shun Lin, William H. Prusoff // J. Med. Chem. — 1978. — Vol. 21, no. 1 (January). — P. 109—112. — ISSN 0022-2623. — DOI:10.1021/jm00199a020.
- 1 2 3 4 Mitsuya, Hiroaki. 3'-Azido-3'-deoxythymidine (BW A509U): an antiviral agent that inhibits the infectivity and cytopathic effect of human T-lymphotropic virus type III/lymphadenopathy-associated virus in vitro : [англ.] / Hiroaki Mitsuya, Kent J. Weinhold, Phillip A. Furman, Marty H. St. Clair, Sandra Nusinoff Lehrman, Robert C. Gallo, Dani Bolognesi, David W. Barry, Samuel Broder. // PNAS. — 1985. — Vol. 82, no. 20 (1 October). — P. 7096–7100. — PMID 2413459.
- 1 2 3 Кристиан Хоффман, Юрген К. Рокштро. Лечение ВИЧ-инфекции 2011 С. 89—90. Антиретровирусная терапия онлайн (2012). Проверено 17 июня 2013. Архивировано 18 июня 2013 года.
- ↑ Зидовудин. Антиретровирусная терапия онлайн (31 июля 2012). Проверено 17 июня 2013. Архивировано 18 июня 2013 года.
Ссылки
Federally approved HIV/AIDS medical practice guidelines. (англ.). A service of the U.S. Department of Health and Human Services (HHS). Проверено 30 января 2016.
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .





