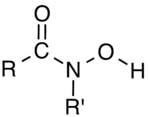
Гидроксамовые кислоты — класс органических соединений, которые содержат функциональную группу RC(O)N(OH)R', где R и R' — углеводородные радикалы. Фактически они представляют собой амиды (RC(O)NHR'), у которых один атом водорода при азоте замещён на гидроксил. Часто используются как хелатирующие агенты металлов. Обладают таутомерией, могут обратимо переходить в гидроксииминовую форму[1].
История
Впервые гидроксамовую кислоту удалось получить в 1869 г. в лаборатории Вильгельма Лоссена. В результате взаимодействия этилоксалата и гидроксиламина была получена оксалогидроксамовая кислота. Чуть позже удалось получить смесь моно-, ди- и трибензоиловых производных гидроксамовых кислот в результате реакции гидроксиламина с хлорангидридом бензойной кислоты[1].
Синтез и реакции

Гидроксамовые кислоты обычно получают из сложных эфиров или хлорангидридов карбоновых кислот. Например, синтез бензогидроксамовой кислоты идёт в соответствии со следующим уравнением реакции[2]:
- C6H5CO2Me + NH2OH → C6H5C(O)NHOH + MeOH
Также гидроксамовые кислоты могут быть получены из альдегидов при помощи реакции Анджели — Римини[en].
Наиболее известная реакция с участием гидроксамовых кислот — это перегруппировка Лоссена. Алкилирование приводит к образованию сложных алкиловых эфиров гидроксамовых кислот, а ацилирование хлорангидридами карбоновых кислот — ацильных производных гидроксамовых кислот[1].
Физические свойства
Ароматические гидроксамовые кислоты — относительно стабильные кристаллические твердые вещества. В целом, гидроксамовые кислоты — менее сильные кислоты, чем соответствующие им карбоновые (рК около 9)[1].
Координационная химия и биохимия
- Галерея
В области координационной химии гидроксамовые кислоты используются в качестве лигандов[3]. Депротонируясь, они превращаются в бидентатные лиганды гидроксоматы, которые связывают ионы металлов. Сродство гидроксоматов к ионам трёхвалентного железа настолько велико, что в результате эволюции у живых организмов появилось целое семейство гидроксамовых кислот, которые функционируют как лиганды и переносчики ионов железа. Таки вещества называются сидерофоры[en] и используются для поглощения ионов железа всеми бактериями и растениями. Использование этих веществ позволяет растворить нерастворимые соединения трёхвалентного железа. Образовавшиеся комплексы затем транспортируются в клетку, где Fe3+ восстанавливается до Fe2+. Сродство гидроксоматов к Fe2+ значительно меньше, чем к Fe3+, поэтому ион двухвалентного железа легко диссоциирует из такого комплекса. У двудольных, не злаковых и дрожжей восстановление сидерофоров осуществляется внеклеточно, а в клетку поступает свободный ион Fe2+. У злаков, остальных грибов и бактерий сидерофор транспортируется в клетку целиком, и лишь затем подвергается восстановлению[4].
Использование
Гидроксамовые кислоты широко используются для флотации редкоземельных минералов. Они применяются для концентрирования и экстракции руд, которые затем подвергаются дальнейшей обработке. Некоторые гидроксамовые кислоты (например, вориностат, белиностат, панобиностат и трихостатин А) являются ингибиторами гистондеацетилазы и поэтому обладают антираковыми свойствами. Дефероксамин, — природное производное гидроксамовой кислоты, — используется в качестве противоядия при отравлении железом. Ещё одна природная гидроксамовая кислота — Фосмидомицин, это ингибитор 1-деокси-D-ксилулозо-5-фосфат редуктоизомеразы (ДКФ редуктоизомераза), а салицилгидроксамовая кислота ингибирует альтернативную оксидазу растений и грибов. Кроме того, ведутся исследования по использованию гидроксамовых кислот для переработки отработанного ядерного топлива.
Примечания
- 1 2 3 4 Beyer-Walter, Lehrbuch der Organischen Chemie, 23. Auflage, S. Hirzel Verlag 1998 ISBN 3-7776-0808-4
- ↑ C. R. Hauser and W. B. Renfrow, Jr «Benzohydroxamic Acid» Org. Synth. 1939, volume 19, p. 15ff.
- ↑ Agrawal, Y K (1979). “Hydroxamic Acids and Their Metal Complexes”. Russian Chemical Reviews. 48 (10): 948. DOI:10.1070/RC1979v048n10ABEH002422.
- ↑ Miller, Marvin J. (November 1989). “Syntheses and Therapeutic Potential of Hydroxamic Acid Based Siderophores and Analogues”. Chemical Reviews. 89 (7): 1563—1579. DOI:10.1021/cr00097a011.
Литература
- Fouché, K. F.; H. J. le Roux; F. Phillips (June 1970). “Complex formation of Zr(IV) and Hf(IV) with hydroxamic acids in acidic solutions”. Journal of Inorganic and Nuclear Chemistry. 32 (6): 1949—1962. DOI:10.1016/0022-1902(70)80604-2. ISSN 0022-1902. Проверено 2009-04-24.
- Barocas, A.; F. Baroncelli; G. B. Biondi; G. Grossi (December 1966). “The complexing power of hydroxamic acids and its effect on behaviour of organic extractants in the reprocessing of irradiated fuels--II : The complexes between benzohydroxamic acid and thorium, uranium (IV) and plutonium (IV)”. Journal of Inorganic and Nuclear Chemistry. 28 (12): 2961—2967. DOI:10.1016/0022-1902(66)80023-4. ISSN 0022-1902. Проверено 2009-04-24.
- Baroncelli, F.; G. Grossi (May 1965). “The complexing power of hydroxamic acids and its effect on the behaviour of organic extractants in the reprocessing of irradiated fuels--I the complexes between benzohydroxamic acid and zirconium, iron (III) and uranium (VI)”. Journal of Inorganic and Nuclear Chemistry. 27 (5): 1085—1092. DOI:10.1016/0022-1902(65)80420-1. ISSN 0022-1902. Проверено 2009-04-24.
- Al-Jarrah, R. H.; A. R. Al-Karaghouli; S. A. Al-Assaf; N. H. Shamon (1981). “Solvent extraction of uranium and some other metal ions with 2-N-butyl-2-ethyl octanohydroxamic acid”. Journal of Inorganic and Nuclear Chemistry. 43 (11): 2971—2973. DOI:10.1016/0022-1902(81)80652-5. ISSN 0022-1902. Проверено 2009-04-24.
- Gopalan, Aravamudan S.; Vincent J. Huber; Orhan Zincircioglu; Paul H. Smith (1992). “Novel tetrahydroxamate chelators for actinide complexation: synthesis and binding studies”. Journal of the Chemical Society, Chemical Communications (17): 1266—1268. DOI:10.1039/C39920001266.
- Koshti, Nirmal; Vincent Huber; Paul Smith; Aravamudan S. Gopalan (1994-02-28). “Design and synthesis of actinide specific chelators: Synthesis of new cyclam tetrahydroxamate (CYTROX) and cyclam tetraacetonylacetone (CYTAC) chelators”. Tetrahedron. 50 (9): 2657—2664. DOI:10.1016/S0040-4020(01)86981-7. ISSN 0040-4020. Проверено 2009-04-30.
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .

