4
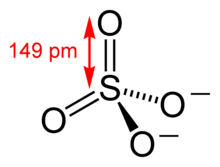
Сульфа́ты — соли серной кислоты H2SO4, а также (в органической химии) полные эфиры серной кислоты (диалкилсульфаты R−O−SO2−O−R) и алкилсульфаты — соли алкилсерных кислот HSO3OR.
Неорганические сульфаты являются ионными соединениями, содержат анион SO2−
4, образуют три ряда солей:
- нормальные, или средние соли (собственно сульфаты, например сульфат калия K2SO4);
- кислые соли (гидросульфаты, или бисульфаты, кроме катионов металла содержат катионы водорода H+, например гидросульфат натрия NaHSO4);
- осно́вные соли (содержат наряду с сульфат-анионом SO2−
4 группы ОН, например Cu3(OH)4SO4
Большинство неорганических сульфатов образуют кристаллы, средние и кислые сульфаты, как правило, растворимы в воде. Нерастворимыми являются сульфаты тяжёлых щёлочноземельных металлов (BaSO4, RaSO4), сульфаты лёгких щёлочноземельных металлов (CaSO4, SrSO4) и сульфат свинца плохо растворимы. Основные сульфаты обычно малорастворимы или нерастворимы либо гидролизуются.
Кристаллогидраты сульфатов некоторых металлов (железа, меди и др.) называют купоросами. Кристаллогидраты сульфатов двойных солей однозарядного и трёхзарядного катионов M+M3+(SO4)2−
2·12H2O называют квасцами (безводные — жжёными квасцами). Кристаллогидраты сульфатов двойных солей однозарядного и двухзарядного катионов M+
2M2+(SO4)2−
2·6H2O называют шенитами, или солями Туттона.
Средние сульфаты щелочных металлов термически устойчивы. Кислые сульфаты щелочных металлов при нагревании разлагаются с отщеплением воды, превращаясь в пиросульфаты (дисульфаты, соли дисерной кислоты):
Осно́вные сульфаты, а также кислые сульфаты металлов, не являющихся щелочными, при нагревании, как правило, разлагаются с отщеплением оксида серы (VI) SO3, образуя оксиды металлов.
Сульфаты широко распространены в природе, образуя целую группу минералов (см. Сульфаты (минералы)), в частности гипс (дигидрат сульфата кальция), мирабилит (декагидрат сульфата натрия), ангидрит (безводный сульфат кальция), барит (сульфат бария), алунит (основный сульфат алюминия и калия) и др. Входят в состав морской воды и минеральных вод.
Качественная реакция на растворимые сульфаты — образование белого нерастворимого осадка сульфата бария при добавлении к раствору хлорида бария.
Используется также осаждение белого сульфата свинца(II) при добавлении к раствору ацетата свинца(II).
См. также
Литература
- Сульфаты неорганические // Химический энциклопедический словарь / Кнунянц И. Л. (гл. ред.). — М.: Советская энциклопедия, 1983. — С. 551. — 792 с. — 100 000 экз..
- Сульфаты органические // Химический энциклопедический словарь / Кнунянц И. Л. (гл. ред.). — М.: Советская энциклопедия, 1983. — С. 551. — 792 с. — 100 000 экз..
- Данилов В. П. Сульфаты неорганические // Химическая энциклопедия: в 5 т / Зефиров Н. С. (гл. ред.). — М.: Большая Российская энциклопедия, 1995. — Т. 4: Полимерные—Трипсин. — С. 456. — 639 с. — 40 000 экз. — ISBN 5-85270-039-8.
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .

