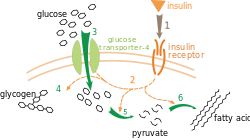
GLUT4 (ГЛЮТ-4, глюкозный транспортёр тип 4) — инсулинзависимый белок-переносчик глюкозы, осуществляет перенос глюкозы, посредством облегчённой диффузии через клеточную мембрану под контролем инсулина. Содержится в отсутствии инсулина почти полностью в цитоплазме[1]. Впервые был обнаружен в клетках жировой ткани и мышечной ткани (скелетные мышцы и миокард). Свидетельство об открытии нового глюкозного транспортёра принадлежит цитологу Дэвиду Джеймсу, который предоставил его в 1988 году[2]. Ген, кодирующий GLUT4 был клонирован[3][4] и картирован в 1989[5]. Ген, кодирующий данный белок у человека — SLC2A4, расположен в 17 хромосоме.
GLUT4 — единственный инсулинзависимый глюкозный транспортёр.
Недавние сообщения показали наличие гена GLUT4 в некоторых участках центральной нервной системы, таких как гиппокамп. Кроме того, ухудшение в инсулинстимулированном обороте GLUT4 в гиппокампе, может привести к снижению метаболической активности и пластичности нейронов гиппокампа, проявляющихся в депрессивных, поведенческих и когнитивных дисфункциях[6][7][8].
Локализация в органах
GLUT4 локализован в следующих органах:
- жировая ткань
- скелетные мышцы
- сердечная мышца (миокард)
Доменная структура
GLUT4 представляет собой трансмембранный белок, состоящий из 509 аминокислотных остатков. Четвертичная структура включает в себя 12 трансмембранных доменов. N- и С-концевая части располагаются внутри цитоплазмы.
Выполняемые функции
Перенос глюкозы во внутриклеточное пространство, посредством инсулинстимулированного сигнала.
Регуляция
Осуществляется непосредственно инсулином

В условиях низкого инсулина в клетках жировой и мышечной ткани большинство GLUT4 (более 90%) отделены от цитоплазматической мембраны в виде внутриклеточных везикул, состоящих из белков, таких как инсулинзависимая аминопептидаза, везикулярного белка — синаптобревина (известный ещё как v-SNARE) и небольшого ГТФ-связывающего белка — Rab-4. При воздействии инсулина начинается процесс быстрой транслокации (перемещения) везикул ГЛЮТ-4 к цитоплазматической мембране, где они закрепляются, образуя комплексы, включающие трансмембранный белок синтаксин-4 (известный как t-SNARE) и синаптобревин. Происходит процесс сливания везикул с цитоплазматической мембраной, увеличивая количество молекул ГЛЮТ-4 в ней и тем самым увеличивается скорость процесса переноса глюкозы во внутрь клетки. ГТФ-связывающий белок Rab-4 покидает везикулу и движется в цитоплазму в ответ на стимуляцию инсулином. Как только происходит устранение инсулинового сигнала ГЛЮТ-4 интернализуется (передвигается во внутрь), отпочковываясь в виде везикул окаймлённых клатрином, от цитоплазматической мембраны. ГЛЮТ-4 сравнительно легко проникают во внутрь эндосомы, где происходит их ресортировка во внутриклеточные ГЛЮТ-4 содержащие везикулы.
Инсулин связывается с инсулиновым рецептором, который представляет собой тирозиновую протеинкиназу, т.е. протеинкиназу, которая фосфорилирует как внутриклеточные домены рецептора по гидроксильной ОН-группе остатков тирозина (происходит так называемое аутофосфорилирование субстрата инсулинового рецептора IRS-1), так и внутриклеточные белки. Аутофосфорилирование субстрата инсулинового рецептора IRS-1 ведёт к усилению первичного сигнала. Эти субстраты образуют комплексы например с фосфоинозитид-3-киназой (ФИ-3-киназа, КФ 2.7.1), точнее с одной из регуляторных субъединиц (p85α), посредством SH2-доменов. Затем субъединица p85α связывается с каталитической субъединицой p110. Активация ФИ-3-киназы является звеном сигнального пути, стимулирующего транслокацию ГЛЮТ-4 из цитоплазмы в плазматическую мембрану, а следовательно — и трансмембранный перенос глюкозы в мышечные и жировые клетки.
На поверхности клетки, GLUT4 позволяет глюкозе, посредством облегчённой диффузии по градиенту концентрации проникать в мышечные и жировые клетки. После того, как глюкоза окажется внутри клетки, она быстро фосфорилируется глюкокиназами в печени или гексокиназами в других тканях, с образованием глюкозо-6-фосфата, который затем участвует либо в процессе гликолиза либо полимеризуется в гликоген. Глюкозо-6-фосфат не может диффундировать обратно из клеток, что также служит для поддержания градиента концентрации по отношению к глюкозе, чтобы она смогла диффундировать во внутрь клетки, посредством пассивного транспорта[9].
Нарушения
Существуют несколько видов нарушений. Это генетические, связанные с мутациями в гене SLC2A4 и, последующей его экспрессией мутантного белка, и функциональные, связанные с нарушениями выполняемых функций.
Нарушения функции ГЛЮТ-4 возможны на следующих этапах:
- передача сигнала инсулина о перемещении этого транспортёра к мембране;
- перемещение транспортёра в цитоплазме;
- включение в состав мембраны;
- отшнуровывание от мембраны и т.д.
Все они могут привести к этиологии инсулиновой резистентности и, последующим развитием сахарного диабета 2 типа.
Взаимодействия с другими белками
Недавние исследования показали, что GLUT4 взаимодействует с так называемым Death-ассоциированным протеином 6 — DAXX[10].
Примечания
- ↑ Е.С. Северин. Биология. — М: ГЭОТАР-МЕД, 2004. — 779 с. — ISBN 5-9231-0254-4.
- ↑ James DE, Brown R, Navarro J, Pilch PF (May 1988). “Insulin-regulatable tissues express a unique insulin-sensitive glucose transport protein”. Nature. 333 (6169): 183—5. DOI:10.1038/333183a0. PMID 3285221.
- ↑ James DE, Strube M, Mueckler M (Mar 1989). “Molecular cloning and characterization of an insulin-regulatable glucose transporter”. Nature. 338 (6210): 83—7. DOI:10.1038/338083a0. PMID 2645527.
- ↑ Birnbaum MJ (Apr 1989). “Identification of a novel gene encoding an insulin-responsive glucose transporter protein”. Cell. 57 (2): 305—15. DOI:10.1016/0092-8674(89)90968-9. PMID 2649253.
- ↑ Bell GI, Murray JC, Nakamura Y, Kayano T, Eddy RL, Fan YS, Byers MG, Shows TB (Aug 1989). “Polymorphic human insulin-responsive glucose-transporter gene on chromosome 17p13”. Diabetes. 38 (8): 1072—5. DOI:10.2337/diabetes.38.8.1072. PMID 2568955.
- ↑ Patel SS, Udayabanu M (Mar 2014). “Urtica dioica extract attenuates depressive like behavior and associative memory dysfunction in dexamethasone induced diabetic mice”. Metabolic Brain Disease. 29 (1): 121—30. DOI:10.1007/s11011-014-9480-0. PMID 24435938.
- ↑ Piroli GG, Grillo CA, Reznikov LR, Adams S, McEwen BS, Charron MJ, Reagan LP (2007). “Corticosterone impairs insulin-stimulated translocation of GLUT4 in the rat hippocampus”. Neuroendocrinology. 85 (2): 71—80. DOI:10.1159/000101694. PMID 17426391.
- ↑ Huang CC, Lee CC, Hsu KS (2010). “The role of insulin receptor signaling in synaptic plasticity and cognitive function”. Chang Gung Medical Journal. 33 (2): 115—25. PMID 20438663.
- ↑ Watson RT, Kanzaki M, Pessin JE (Apr 2004). “Regulated membrane trafficking of the insulin-responsive glucose transporter 4 in adipocytes”. Endocrine Reviews. 25 (2): 177—204. DOI:10.1210/er.2003-0011. PMID 15082519.
- ↑ Lalioti VS, Vergarajauregui S, Pulido D, Sandoval IV (May 2002). “The insulin-sensitive glucose transporter, GLUT4, interacts physically with Daxx. Two proteins with capacity to bind Ubc9 and conjugated to SUMO1”. The Journal of Biological Chemistry. 277 (22): 19783—91. DOI:10.1074/jbc.M110294200. PMID 11842083.
См. также
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .