GLUT1 (ГЛЮТ-1, глюкозный транспортёр тип 1) — однонаправленный белок-переносчик глюкозы. У человека кодируется геном SLC2A1[2]. GLUT1 способствует облегченному переносу глюкозы через плазматическую мембрану клеток млекопитающих[3].
Широко распространен в фетальных тканях. У взрослых максимальная экспрессия наблюдается в эритроцитах, а также в клетках эндотелия барьерных тканей, таких как ГЭБ.
Обнаружение
GLUT1 был первым обнаруженным переносчиком глюкозы. GLUT1 крайне консервативен.[2] У человека и мышей гомологичность данного белка составляет 98%. Гомологичность с другими глюкозными транспортёрами составляет 40%.
Функция
Энергопроизводящий метаболизм в эритроцитах зависит от постоянного притока глюкозы из плазмы крови, в которой концентрация глюкозы поддерживается на уровне около 5 ммоль/л. Глюкоза проникает в эритроциты через глюкозный транспортёр благодаря облегченной диффузии, со скоростью проникновения, в 50 000 раз превышающей скорость простой трансмембранной диффузии. Глюкозные транспортёры в эритроцитах (GLUT1) — интегральные мембранные белки, имеющие 12 гидрофобных сегментов, каждый из которых, как считается, является пересекающей мембрану спиралью. Детальная структура GLUT1 пока неизвестна, но одна из перспективных моделей предполагает, что несколько расположенных друг рядом с другом спиралей формируют трансмембранный канал с гидрофильными остатками, которые могут связываться с глюкозой по ходу её движения по каналу[4].
GLUT1 отвечает за усвоение базальной глюкозы, необходимое для обеспечения процесса дыхания всех клеток. Уровни экспрессии GLUT1 в клеточных мембранах увеличиваются при уменьшении уровня глюкозы, и наоборот.
GLUT1 также является важным рецептором, участвующим в усвоении витамина C, особенно у млекопитающих, которые его не производят. У млекопитающих, производящих витамин C, вместо GLUT1 часто экспрессируется GLUT4[5].
Структура
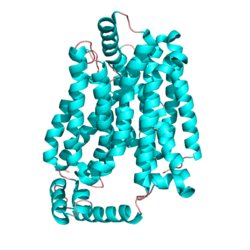
GLUT1 следует уравнению Михаэлиса — Ментен и содержит 12 пересекающих мембрану альфа-спиралей, каждая из которых состоит из 20 аминокислотных остатков. Анализ показывает, что спирали являются амфифильными, с одной стороны полярными, с другой — гидрофобными. Шесть из этих альфа-спиралей связываются вместе в мембране, в центре создавая канал, через который может проходить глюкоза. Снаружи канала расположены гидрофобные регионы, рядом с хвостами жирных кислот мембраны.
Клиническая значимость
Мутации гена SLC2A1 ответственны за дефицит GLUT1, также известный как болезнь Де Виво, редкое аутосомно-доминантное заболевание[6]. Это заболевание характеризуется низкой концентрацией глюкозы в спинномозговой жидкости (гипогликорахия), формой нейрогликопении, возникающей из-за нарушенного транспорта глюкозы через гемато-энцефалический барьер.
GLUT1 также выступает рецептором для T-лимфотропного вируса человека, благодаря которому вирус проникает в клетки[7].
Также была продемонстрирована возможность использования GLUT1 в качестве точного гистохимического маркера для младенческой гемангиомы[8].
Взаимодействия
Было продемонстрировано взаимодействие GLUT1 с белком GIPC1[9].
В мозге есть два типа белка GLUT1: 45k и 55k. GLUT1 45k встречается в клетках астроглии, а GLUT1 55k в капиллярах мозга и отвечает за транспорт глюкозы из крови через гематоэнцефалографический барьер. Недостаток последнего приводит к снижению уровня глюкозы в спинномозговой жидкости (менее чем 60 mg/dl), что может приводить к судорогам.
DERL3, недавно открытый ингибитор белка GLUT1, метилируется при коллатеральном раке. При этом таком раке метилирование DERL3 по-видимому опосредует Эффект Варбурга[10].
Ингибиторы
Fasentin — низкомолекулярный ингибитор внутриклеточного домена GLUT1, предотвращает поглощение глюкозы[11].
См. также
Примечания
- ↑ Deng Dong, Xu Chao, Sun Pengcheng, Wu Jianping, Yan Chuangye, Hu Mingxu, Yan Nieng. Crystal structure of the human glucose transporter GLUT1 // Nature. — 2014. — 18 мая (т. 510, № 7503). — С. 121—125. — ISSN 0028-0836. — DOI:10.1038/nature13306.
- 1 2 Mueckler M, Caruso C, Baldwin SA, Panico M, Blench I, Morris HR, Allard WJ, Lienhard GE, Lodish HF (September 1985). “Sequence and structure of a human glucose transporter”. Science. 229 (4717): 941—5. DOI:10.1126/science.3839598. PMID 3839598.
- ↑ Olson AL, Pessin JE (1996). “Structure, function, and regulation of the mammalian facilitative glucose transporter gene family”. Annu. Rev. Nutr. 16: 235—56. DOI:10.1146/annurev.nu.16.070196.001315. PMID 8839927.
- ↑ Nelson DL, Cox MM. Lehninger, Principles of Biochemistry. — W. H. Freeman and Company, 2008. — ISBN 978-0-7167-7108-1.
- ↑ Montel-hagen A, Kinet S, Manel N; et al. (2008). “Erythrocyte Glut1 Triggers Dehydroascorbic Acid Uptake in Mammals Unable to Synthesize Vitamin C”. Cell. 132 (6): 1039—1048. DOI:10.1016/j.cell.2008.01.042. PMID 18358815. Lay summary – ScienceDaily (2008-03-21).
- ↑ Seidner G, Alvarez MG, Yeh JI; et al. (1998). “GLUT-1 deficiency syndrome caused by haploinsufficiency of the blood–brain barrier hexose carrier”. Nat. Genet. 18 (2): 188—91. DOI:10.1038/ng0298-188. PMID 9462754.
- ↑ Manel N, Kim FJ, Kinet S, Taylor N, Sitbon M, Battini JL (November 2003). “The ubiquitous glucose transporter GLUT-1 is a receptor for HTLV”. Cell. 115 (4): 449—59. DOI:10.1016/S0092-8674(03)00881-X. PMID 14622599.
- ↑ North PE, Waner M, Mizeracki A, Mihm MC (January 2000). “GLUT1: a newly discovered immunohistochemical marker for juvenile hemangiomas”. Hum. Pathol. 31 (1): 11—22. DOI:10.1016/S0046-8177(00)80192-6. PMID 10665907.
- ↑ Bunn RC, Jensen MA, Reed BC (April 1999). “Protein interactions with the glucose transporter binding protein GLUT1CBP that provide a link between GLUT1 and the cytoskeleton”. Mol. Biol. Cell. 10 (4): 819—32. DOI:10.1091/mbc.10.4.819. PMC 25204. PMID 10198040.
- ↑ Lopez-Serra, P. et al. A DERL3-associated defect in the degradation of SLC2A1 mediates the Warburg effect. Nat. Commun. 5:3608 doi: 10.1038/ncomms4608 (2014). https://www.ncbi.nlm.nih.gov/pubmed/24699711
- ↑ Wood TE, Dalili S, Simpson CD, Hurren R, Mao X, Saiz FS; et al. (2008). “A novel inhibitor of glucose uptake sensitizes cells to FAS-induced cell death”. Mol Cancer Ther. 7 (11): 3546–55. DOI:10.1158/1535-7163.MCT-08-0569. PMID 19001437.
Литература
- North PE, Waner M, Mizeracki A, Mihm MC (January 2000). “GLUT1: a newly discovered immunohistochemical marker for juvenile hemangiomas”. Hum. Pathol. 31 (1): 11—22. DOI:10.1016/S0046-8177(00)80192-6. PMID 10665907.
- Hruz PW, Mueckler MM (2002). “Structural analysis of the GLUT1 facilitative glucose transporter (review)”. Mol. Membr. Biol. 18 (3): 183—93. DOI:10.1080/09687680110072140. PMID 11681785.
- Baumann MU, Deborde S, Illsley NP (2003). “Placental glucose transfer and fetal growth”. Endocrine. 19 (1): 13—22. DOI:10.1385/ENDO:19:1:13. PMID 12583599.
- Mobasheri A, Richardson S, Mobasheri R; et al. (2006). “Hypoxia inducible factor-1 and facilitative glucose transporters GLUT1 and GLUT3: putative molecular components of the oxygen and glucose sensing apparatus in articular chondrocytes”. Histol. Histopathol. 20 (4): 1327—38. PMID 16136514.
- Кожанова Т.В. ,Жилина С.С.,Мещерякова Т.И., Айвазян С.О., Осипова К.В., Сушко Л.М., Лукьянова Е.Г., Притыко А.Г. Синдром дефицита транспортера глюкозы I типа (болезнь де Виво): клинические и генетические аспекты. // Медицинская генетика. — 2016. — № 7. — С. 28–32. — ISSN 2073-7998.
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .