| Ксенонистая кислота | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Дигидрокси(диоксо)ксенон |
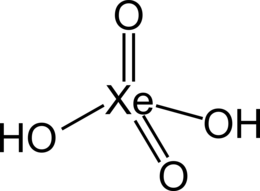
| Хим. формула | H2XeO4 |
| Физические свойства | |
| Молярная масса | 197,306 г/моль |
| Термические свойства | |
| Т. плав. | 290,26 °C |
| Т. кип. | 666,25 °C |
| Классификация | |
| Рег. номер CAS | 1402134-83-1 |
| PubChem | 23422578 |
| SMILES | |
| InChI | |
| ChemSpider | 10466143 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Ксенонистая кислота — соединение благородного газа, кислота ксенона в степени окисления +6, средней силы. Формула ее отображается либо H2XeO4, либо H6XeO6. В основном, соли образуются от второй формы кислоты.
Применяется в органической химии как сильный окислитель. При ее разложении освобождается большое количество газообразных продуктов, таких как ксенон, кислород и озон.
Существование ксенонистой кислоты было предположено Лайнусом Полингом в 1933 году[1].
Соли ксенонистой кислоты называются ксенатами, в состав их входит анион XeO42−. Они разлагаются на ксенон и перксенаты:
Соли, содержащие полностью депротонированный анион XeO42−, в настоящее время неизвестны[2].
Получение
Получается путём растворения триоксида ксенона в воде:
H2XeO4 также образуется в результате гидролиза фторида ксенона(VI) при н. у.:
При добавлении гидроксида бария к данной реакции, выпадает осадок BaXeO4, который разлагается при температуре 125 °C на ксенон, оксид бария и кислород. При взаимодействии со свежеприготовленным осадком гидроксида меди образуется ксенат меди CuXeO4, который, возможно, обладает сверхпроводимостью.
Примечания
- ↑ Linus Pauling (June 1933). “The Formulas of Antimonic Acid and the Antimonates”. J. Am. Chem. Soc. 55 (5): 1895—1900. DOI:10.1021/ja01332a016. Используется устаревший параметр
|month=(справка) - ↑ Inorganic chemistry. — Academic Press, 2001. — P. 399. — ISBN 0-12-352651-5.
| Это заготовка статьи о неорганическом веществе. Вы можете помочь проекту, дополнив её. |
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .


