Циангидрины (α-гидроксинитрилы, нитрилы α-оксикислот) — соединения, содержащие нитрильную и гидроксильную группы при одном углеродном атоме, формально — продукты присоединения синильной кислоты к альдегидам и кетонам[1].
В систематической номенклатуре циангидрины именуются как гидроксинитрилы, однако используются и тривиальные названия, образованные добавлением суффикса -циангидрин к названию карбонильного соединения-предшественника, например: (CH3)2C(OH)CN — ацетонциангидрин (2-гидрокси-2-метилпропаннитрил).
Синтез
Действие цианидов на карбонильные соединения
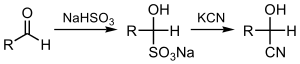
Основным методом синтеза как в лабораторной практике, так и в промышленности, является присоединение цианистого водорода к карбонильным соединениям:
- RR1CO + HCN RR1C(OH)CN
В эту реакцию вступают алифатические, большинство ароматических и многое гетероциклические альдегиды, алифатические и алициклические кетоны. Ароматические кетоны в реакцию не вступают. Образованию циангидринов препятствуют стерические затруднения, в случае ароматических и гетероциклических альдегидов, в которых ароматический заместитель стабилизирует образование циангидрин-карбаниона, побочным процессом является бензоиновая конденсация карбаниона со второй молекулой альдегида:
Реакция может проводиться в щелочной водной или водно-спиртовой среде с цианидами щелочных металлов в присутствии КОН или Na2CO3 при температурах 0-50 °C (модификация Ульте) либо с использованием цианистого водорода в момент выделения при добавлении уксусной кислоты в водный раствор цианида щелочного металла и карбонильного соединения при 20-30 °C (модификация Уреха).
Циангидрины могут быть также получены действием цианидов на бисульфитные производные альдегидов и кетонов:
В качестве «безцианидного» метода синтеза циангидринов альдегидов используется обменная реакция с циангидридами кетонов (обычно - с легкодоступным ацетонциангидрином):
- RCHO + (CH3)2C(OH)CN RC(OH)CN + (CH3)2CO
Другие методы синтеза
Циангидрины могут быть синтезированы и функционализацией соответствующих α-гидроксисоединений.
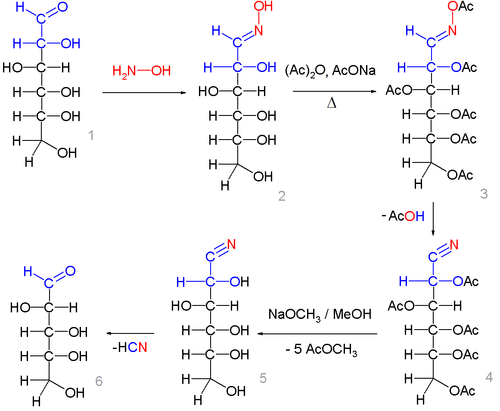
Так, оксимы α-гидроксиальдегидов под действием кислотных и ацилирующих агентов (уксусный ангидрид и т.п.) образуют циангидрины:
- RR'C(OH)-CH=NOH + Ac2O RR'C(OH)-CH=NOAc + AcOH
- RR'C(OH)-CH=NOAc RR'C(OH)CN + AcOH
Нахождение в природе
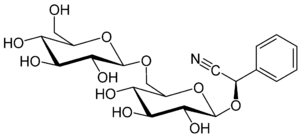
Циангидрины являются агликонами цианогенных гликозидов, встречающихся во многих видах растений: бензальдегидциангидрин амигдалина растений рода слива Prunus и дуррина сорго, ацетонциангидрин линамарина маниоки и льна, этилметилкетонциангидрин лотаустралина маниоки, клевера ползучего и Lotus australis и др.
Высвобождающиеся при гидролизе цианогенных гликозидов циангидрины в физиологических условиях разлагаются с образованием соответствующего карбонильного соединения и синильной кислоты, что обуславливает токсичность растений, содержащих цианогенные гликозиды.
У двупарноногих многоножек рода Aphelora — A. corrugata и A. trimaculata бензальдегидциангидрин (наряду с бензоилцианидом) синтезируется и накапливается в ядовитых железах и, в случае опасности, гидролизуется с выделением синильной кислоты[2],[3].
Применение
Промышленное применение
Ацетонциангидрин является крупнотоннажным продуктом органического синтеза и используется как сырье в производстве производных метакриловой кислоты — метилметакрилата:
- (CH3)2C(OH)CN + H2SO4 → CH2=C(CH3)CONH2·H2SO4
- CH2=C(CH3)CONH2·H2SO4 + CH3OH → CH2=C(CH3)COOCH3 + NH4HSO4
- (CH3)2C(OH)CN → CH2=C(CH3)CN + H2O
и других соединений, применяемых в качестве мономеров для получения полимеров — полиакрилатов.
Использование в органическом синтезе
Образование циангидринов из альдоз является первой стадии их гомологизации по Килиани-Фишеру:
Синтез циангидринов - нитрилов альдоновых кислот - из оксимов альдоз с дальнейшим отщеплением от них цианистого водорода используется в химии углеводов как метод укорочения углеродной цепи альдоз на одно звено (реакция Воля):
Примечания
| Это заготовка статьи по органической химии. Вы можете помочь проекту, дополнив её. |
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .