Тетрафтораммоний | |
|---|---|
Общие | |
| Хим. формула | F₄N+ |
Классификация | |
| Номер CAS | 30494-78-1 |
| PubChem | 5460510 |
| ChemSpider | 4574019 |
| ChEBI | 30233 |
[N+](F)(F)(F)F | |
1S/F4N/c1-5(2,3)4/q+1 | |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
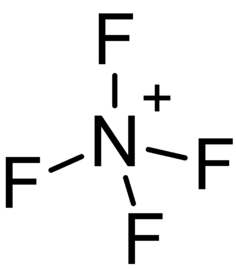
Тетрафтораммо́ний NF4+ — комплексный неорганический катион, представляющий собой аммоний, все четыре атома водорода в котором замещены фтором[1]. Тетрафтораммоний является сильным окислителем и одним из немногих устойчивых соединений (и единственным бескислородным), в которых азот имеет степень окисления +5.
Структура
Ион тетрафтораммония изоэлектронен молекуле тетрафторметана. Аналогично ему (а также аммонию), тетрафтораммоний имеет правильную тетраэдрическую форму (атом азота в центре, атомы фтора по вершинам), длина каждой связи N-F равна примерно 124 пм, угол между каждой парой связей ≈109°28′16″.
Соли
Ион тетрафтораммония даёт соли с разнообразными фтористыми анионами, такими, как:
- Бифторид [HF2]−;
- Тетрафторборат [BF4]−, тетрафторалюминат [AlF4]−;
- Тетрафторбромат [BrF4]−;
- Пентафториды [XF5]−, где X = Ge, Sn, Ti;
- Гексафториды [XF6]−, где X = P, As, Sb, Bi, Pt;
- Гептафториды [XF7]−, где X = W, U, Xe;
- Октафторид ксенона [XeF8]2− [2]
Он также даёт соли с оксифторидами [XF5O]−, где X = Br; [XF5O]−, где X = W, U; фторсерной кислотой [SO3F]−
Что касается чисто кислородных анионов, то с ними для тетрафтораммония получены только перхлорат [NF4]+[ClO4]− [3] и нитрат NF4+NO3− [4], последняя соль интересна тем, что и в катионе, и в анионе азот имеет максимально возможную степень окисления +5.
Получение
Соли тетрафтораммония синтезируют, окисляя трифторид азота фтором в присутствии сильных кислот Льюиса (как правило, фтористых), действующих как акцепторы фторид-иона. В оригинальном синтезе Толберга, Рьюика и Стрингхэма в 1966 году использовался пентафторид сурьмы[5]:
Похожим образом при умеренном нагреве осуществляется синтез гексафторарсената тетрафтораммония[5]:
Реакция фтора, трифторида бора и трифторида азота при 800 °C даёт тетрафторборат тетрафтораммония[6], интересный тем, что оба образующих его комплексных иона изоэлектронны:
Соли тетрафтораммония могут быть получены также окислением трифторида азота дифторидом криптона в присутствии фторсодержащих кислот Льюиса.
Применение
К.О. Кристи предложил соли тетрафтораммония как твердые хранилища газообразного фтора. Некоторые из солей тетрафтораммония могут разлагаться с выделением только газообразных продуктов и были разработаны пиротехнические составы для генерации фтора.
Примечания
- ↑ Igor V Nikitin и V Ya Rosolovskii. Tetrafluoroammonium Salts (англ.) // Russian Chemical Reviews. — 1985. — Vol. 54, no. 5. — P. 426. — DOI:10.1070/RC1985v054n05ABEH003068.
- ↑ Karl O. Christe, William W. Wilson. Perfluoroammonium and alkali-metal salts of the heptafluoroxenon(VI) and octafluoroxenon(VI) anions (англ.) // Inorganic Chemistry. — 1982. — Vol. 21. — P. 4113–4117. — DOI:10.1021/ic00142a001.
- ↑ Karl O. Christe, William W. Wilson. Synthesis and characterization of tetrafluoroammonium(1+) tetrafluorobromate(1-) and tetrafluoroammonium(1+) tetrafluorooxobromate(1-) (англ.) // Inorganic Chemistry. — 1986. — Vol. 25. — P. 1904–1906. — DOI:10.1021/ic00231a038.
- ↑ Berthold Hoge, Karl O Christe. On the stability of NF4+NO3- and a new synthesis of fluorine nitrate (англ.). — 2001. — Vol. 110, iss. 2. — P. 87-88. — DOI:10.1016/S0022-1139(01)00415-8.
- 1 2 Sykes, A. G. Advances in Inorganic Chemistry. — Academic Press, 1989. — ISBN 0120236338.
- ↑ Patnaik, Pradyot. Handbook of inorganic chemicals. — McGraw-Hill Professional, 2002. — ISBN 0070494398.
Литература
Никитин И. В., Росоловский В. Я. Соли тетрафтораммония // АН СССР Успехи химии : журнал. — М., 1985. — Т. LIV, вып. 5. — С. 722-740. — ISSN 0042-1308.
| Это заготовка статьи о неорганическом веществе. Вы можете помочь проекту, дополнив её. |
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .
![{\mathsf {2NF_{3}+2SbF_{5}+F_{2}\rightarrow 2[NF_{4}][SbF_{6}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ba4e22e509f2039470afea6e4416d3ecaf5bd3ed)
![{\mathsf {2NF_{3}+2AsF_{5}+F_{2}\rightarrow 2[NF_{4}][AsF_{6}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d2577efeeb721ac519d8ee7094a3b0aae177edbd)
![{\mathsf {2NF_{3}+2BF_{3}+F_{2}\rightarrow 2[NF_{4}][BF_{4}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4893693c44b8b4dea2df865250757abbe9a1d3d8)