| Фруктозо-1,6-бисфосфатаза | |
|---|---|
 Кристаллическая структура фруктозы-1,6-бисфосфатазы печени кролика. Разрешение 2,3 ангстрем. | |
| Идентификаторы | |
| Символ | FBPase |
| Pfam | PF00316 |
| Pfam clan | CL0171 |
| InterPro | IPR000146 |
| PROSITE | PDOC00114 |
| SCOP | 1frp |
| SUPERFAMILY | 1frp |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
| Фруктозо-1,6-бисфосфатаза в твёрдом состоянии | |
|---|---|
| Идентификаторы | |
| Символ | FBPase_2 |
| Pfam | PF06874 |
| Pfam clan | CL0163 |
| InterPro | IPR009164 |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
| Фруктозо-1,6-бисфосфатаза | |
|---|---|
 Кристаллическая структура фруктозо-1,6-бисфосфатазы | |
| Идентификаторы | |
| Символ | FBPase_3 |
| Pfam | PF01950 |
| InterPro | IPR002803 |
| SCOP | 1umg |
| SUPERFAMILY | 1umg |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
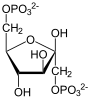
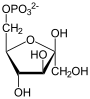
Фруктозо-1,6-бисфосфатаза, также Фруктозо-1,6-дисфосфатаза (ФБФ-аза, FBP сокр. от англ. Fructose 1,6-bisphosphatase, шифр КФ 3.1.3.11) — фермент из группы фосфатаз (тип гидролазы), катализирующий реакцию гидролиза фруктозо-1,6-бисфосфата до фруктозо-6-фосфата с образованием неорганического фосфата по реакции:
Данная реакция протекает в глюконеогенезе и цикле Кальвина, которые относят к анаболическими процессами. Фруктозо-1,6-бисфосфатаза катализирует обратную реакцию, по отношению к реакции, катализируемой фосфофруктокиназой в процессе гликолиза[1][2]. Эти ферменты катализируют реакции только в одном направлении, и регулируются метаболитами, такими как фруктозо-2,6-бисфосфат, так что высокая активность одного из двух ферментов сопровождается низкой активностью другого. Известно, что фруктозо-2,6-бисфосфат способен также аллостерически связываться с фруктозо-1,6-бисфосфатазой, тем самым ингибируя её, но активирует при этом фосфофруктокиназу. ФБФ-аза участвует в различных метаболических путях и встречается у большинства организмов. ФБФ-азе для катализа в качестве кофакторов требуются ионы двухвалентных металлов (предпочтительнее Мg2+ и Мn2+), при этом ионы лития Li+ являются мощными ингибиторами.
Ген, кодирующий данные фермент — FBP1, локализован на 9-ой хромосоме.
Структура
Было отмечено, что фолд фруктозо-1,6-бисфосфатазы свиньи идентичен инозитол-1-фосфатазе (ИМФ-азе)[3]. Инозитолполифосфат 1-фосфатаза (ИПФ-аза), ИМФ-аза и ФБФ-аза имеют мотив последовательности (Asp-Pro-Ile/Leu-Asp-Gly/Ser-Thr/Ser), который, как было показано, связывает ионы металлов и участвует в катализе. Этот мотив также встречается в дистанционно связанных грибковых, бактериальных и дрожжевых гомологах ИМФ-азы. Было высказано предположение, что эти белки определяют древнее структурно-консервативное семейство, вовлечённое в различные метаболические пути, включая сигнализацию инозитолом, глюконеогенез, усвоение сульфата и, возможно, метаболизм хинона[4].
Распределение видов
Три различные группы фруктозо-1,6-бисфосфатазы были идентифицированы у эукариот и бактерий (ФБФ-азы I—III)[5]. Ни одна из этих групп до сих пор не была найдена в археях, однако, новая группа ФБФ-аз (ФБФ-азы IV), которая также проявляет свойства инозитол монофосфатазы, недавно выявлена у архей[6].
Новая группа ФБФ-аз (ФБФ-азы V) встречается в термофильных археях и гипертермофильных бактериях Aquifex aeolicus[7].
Участие в лечении диабета
Фруктозо-1,6-бисфосфатаза также играет ключевую роль в лечении сахарного диабета 2 типа. Это заболевание характеризуется гипергликемией (повышенной концентрацией глюкозы в крови), которая вызывает множество серьёзных проблем, и в лечении часто приходится акцентировать внимание на снижение уровня сахара в крови[8][9][10]. Усиленный глюконеогенез в печени является одной из основных причин перепродукции глюкозы у этих больных, и поэтому ингибирование глюконеогенеза является разумным способом для лечения сахарного диабета 2 типа.
Дефицит
Мутации в гене FBP1 могут приводить к наследственной недостаточности фруктозо-1,6-бисфосфатазы. Это аутосомно-рецессивное заболевание, характеризующееся нарушениям процесса глюконеогенеза, которые приводят к гипогликемии, лактатацидозу, гипервентиляции, судорогам и гипогликемической коме. Особенно опасны эти проявления среди новорожденных, так как среди них наблюдается высокая летальность.
Примечания
- ↑ Marcus F, Harrsch PB (May 1990). “Amino acid sequence of spinach chloroplast fructose-1,6-bisphosphatase”. Archives of Biochemistry and Biophysics. 279 (1): 151—7. DOI:10.1016/0003-9861(90)90475-E. PMID 2159755.
- ↑ Marcus F, Gontero B, Harrsch PB, Rittenhouse J (Mar 1986). “Amino acid sequence homology among fructose-1,6-bisphosphatases”. Biochemical and Biophysical Research Communications. 135 (2): 374—81. DOI:10.1016/0006-291X(86)90005-7. PMID 3008716.
- ↑ Zhang Y, Liang JY, Lipscomb WN (Feb 1993). “Structural similarities between fructose-1,6-bisphosphatase and inositol monophosphatase”. Biochemical and Biophysical Research Communications. 190 (3): 1080—3. DOI:10.1006/bbrc.1993.1159. PMID 8382485.
- ↑ York JD, Ponder JW, Majerus PW (May 1995). “Definition of a metal-dependent/Li(+)-inhibited phosphomonoesterase protein family based upon a conserved three-dimensional core structure”. Proceedings of the National Academy of Sciences of the United States of America. 92 (11): 5149—53. DOI:10.1073/pnas.92.11.5149. PMC 41866. PMID 7761465.
- ↑ Donahue JL, Bownas JL, Niehaus WG, Larson TJ (Oct 2000). “Purification and characterization of glpX-encoded fructose 1, 6-bisphosphatase, a new enzyme of the glycerol 3-phosphate regulon of Escherichia coli”. Journal of Bacteriology. 182 (19): 5624—7. DOI:10.1128/jb.182.19.5624-5627.2000. PMC 111013. PMID 10986273.
- ↑ Stec B, Yang H, Johnson KA, Chen L, Roberts MF (Nov 2000). “MJ0109 is an enzyme that is both an inositol monophosphatase and the 'missing' archaeal fructose-1,6-bisphosphatase”. Nature Structural Biology. 7 (11): 1046—50. DOI:10.1038/80968. PMID 11062561.
- ↑ Rashid N, Imanaka H, Kanai T, Fukui T, Atomi H, Imanaka T (Aug 2002). “A novel candidate for the true fructose-1,6-bisphosphatase in archaea”. The Journal of Biological Chemistry. 277 (34): 30649—55. DOI:10.1074/jbc.M202868200. PMID 12065581.
- ↑ Dang, Qun, Paul D. Van Poelje, and Mark D. Erion. «The discovery and development of MB07803, a second-generation fructose-1,6-bisphosphatase inhibitor with improved pharmokinetic properties, as a potential treatment of type 2 diabetes.» RSC Drug Discoveries Series No 27. 2012. 306—323.Web.
- ↑ Hofmann, F.B. and Munchen. «Handbook of experimental pharmacology: Diabetes — perspectives in drug therapy.» Springer-Verlag Berlin Heidelverg 203 (2011). Web.
- ↑ Poelje, P. D. Van, S. C. Potter, V. C. Chandramouli, et al. «Inhibition of Fructose 1,6-Bisphosphatase Reduces Excessive Endogenous Glucose Production and Attenuates Hyperglycemia in Zucker Diabetic Fatty Rats.» Diabetes 55.6 (2006): 1747—754. Web.
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .