| Оксид золота | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Оксид золота(III) |
| Традиционные названия | Окись золота |
| Хим. формула | Au2O3 |
| Физические свойства | |
| Состояние | красно-бурый порошок |
| Молярная масса | 441,93 г/моль |
| Плотность | 10,38 г/см³ |
| Химические свойства | |
| Растворимость в воде | не раств. |
| Классификация | |
| Рег. номер CAS | 1303-58-8 |
| PubChem | 164805 |
| Рег. номер EINECS | 215-122-1 |
| SMILES | |
| InChI | |
| Номер ООН | <-- номер UN --> |
| ChemSpider | 144478 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Окси́д зо́лота(III) — бинарное неорганическое химическое соединение золота и кислорода с формулой Au2O3. Наиболее устойчивый оксид золота.
Получение
Получается из гидроксида золота(III) Au2O3 x H2O обезвоживанием при нагревании. Полная потеря воды наступает при температуре около 200о С.[1]. Полученный таким образом оксид золота(III) аморфен. Имеет красный или красно-бурый цвет. Примесь бурого, как и в случае гидроксида золота(III), обычно связывают с присутствием небольшого количества золота(0). Монокристаллы Au2O3 были получены из аморфного оксида гидротермальным синтезом в кварцевой ампуле, заполненной на треть смесью хлорной кислоты HClO4 и перхлората щелочного металла (температура синтеза 235—275о С, давление до 30 МПа). Полученные монокристаллы имели рубиново-красный цвет[1].
Свойства
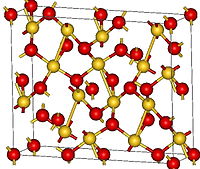
Структура кристаллического Au2O3 орторомбическая, группа Fdd2. Атомы золота имеют тетрагональную (близкую к квадратной) координацию атомами кислорода со средним расстоянием Au-O 2,02—2,03 А. Часть атомов кислорода являются мостиковыми — одни связаны с двумя атомами золота, другие с тремя[2][3].
По данным кристаллографии, плотность равна 10,38 г / см3.
Нагрев аморфного оксида золота(III) до 260—300о С приводит к полному разложению с выделением кислорода и металлического золота[1], хотя разложение начинается уже при более низкой температуре.
Оксид золота(III) нерастворим в воде. Заметно, хотя и медленно, растворяется в растворах щелочей, образуя тетрагидроксокомплекс Au(OH)4-. Встречающиеся указания на амфотерность требуют уточнения. Поскольку золото(III) никогда не образует в растворе простых солей с катионом Au3+, а получаются только комплексные формы, то растворимость Au2O3 в некоторых кислотах обусловлена не только взаимодействием с H+, но в первую очередь именно комплексообразованием с анионом кислоты. Так, оксид золота(III) хорошо растворяется в соляной кислоте, давая HAuCl4. Умеренно растворим в азотной и серной кислотах, давая смешанные аквагидроксонитратные или аквагидроксосульфатные комплексы типа Au(OH)i(H2O)jXkz (где i + j + k = 4, X = NO3 или SO4, z = -i + kzX). Нерастворим в хлорной кислоте любой концентрации.
Оксид золота в виде пленки на инертной подложке испытывался для получения токопроводящих соединений («золотых дорожек») в микроэлектронике. Пленки получали магнетронным напылением, разложение оксида до золота в нужных местах проводили при помощи лазера[4]
.
Примечания
- 1 2 3 Schwarzmann E., Mohn J., Rumpel H. Uber eienkristalle von gold oxid Au2O3 // Z. Naturforschung. 1976., B. 31b, h 1, P. 135.
- ↑ Jones P. G., Rumpel H., Sheldrick G. M., Schwarzmann E. Gold(III) oxide and oxychloride //Gold bulletin. 1980. V 13, Issue 2 , p 56. DOI 10.1007/BF03215453
- ↑ Jones P. G., Rumpel H., Schwarzmann E., Sheldrick G. M., Paulus H. Gold(III) oxide // Acta crystallographica. 1979. Sect. B. V. B35. part 6. p.1435-1437
- ↑ Machalett F., Edinger K., Melngailis J., M. Diegel M., Steenbeck K., E. Steinbeiss E. Direct patterning of gold oxide thin films by focused ion-beam irradiation //Applied Physics A: Materials Science & Processing. 2000. V. 71, N. 3, p. 331—335, DOI: 10.1007/s003390000598
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .