Дендротоксины — класс пресинаптических нейротоксинов, вырабатываемых змеями рода мамба и блокирующих определённые подтипы потенциалзависимых калиевых каналов в нейронах, тем самым повышая высвобождение ацетилхолина в нервно-мышечных синапсах. Благодаря высокой эффективности и селективности для калиевых каналов, дендротоксины оказались чрезвычайно полезными в качестве фармакологических средств для изучения структуры и функции этих белков ионных каналов.
Функциональные эффекты в нервной системе
Дендротоксины блокируют определенные подтипы потенциалзависимых каналов для калия (K+) в нейронах. В нервной системе потенциалзависимые K+ каналы отвечают за реполяризацию мембраны и контролируют длительность потенциалов действия. Дендротоксин, как было показано, связывается с калиевыми каналами перехватов Ранвье мотонейронов[1] и блокирует активность калиевых каналов. Таким образом, дендротоксины увеличивают продолжительность потенциалов действия и повышают высвобождение ацетилхолина в нервно-мышечном синапсе, что может приводить к мышечной перевозбудимости и судорогам.
Структура дендротоксинов
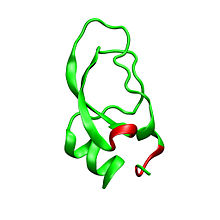
Дендротоксины - белки массой ~ 7kDa, состоящие из одной пептидной цепи из приблизительно 57-60 аминокислот. Были выделены несколько гомологов α-дендротоксина, все обладающие несколько иной последовательностью. Тем не менее, молекулярная архитектура и конформация этих белков очень похожи. Дендротоксины обладают очень короткой 310-спиралью вблизи N-конца пептида, в то время как два оборота α-спирали происходит вблизи С-конца. Двунитевой антипараллельный β-лист занимает центральную часть молекулярной структуры. Эти две β-нити соединены искаженной областью β-оборота[2], что, предположительно, играет важную роль в активности связывания белка. Все дендротоксины сшиты тремя дисульфидными связями, которые добавляют стабильность белку и в значительной степени определяют его конформацию. Радикалы цистеина, образующие эти дисульфидные связи, идентичны по расположению у всех членов семейства дендротоксинов, они расположены в C7-C57, С16-С40, и С32-С53 участках (нумерация согласно α-дендротоксинам).
Дендротоксины структурно гомологичны ингибиторам сериновых протеаз (ИСП), в том числе апротинину. Было показано, что последовательности α-дендротоксина и ИСП идентичны на 35% и имеют идентичные дисульфидные связи. Несмотря на структурную гомологию между этими двумя белками, дендротоксины не оказывают никакого ощутимого ингибирующего действия на фактор свертывания, в отличие от ИСП. Эта потеря активности, возможно, является результатом отсутствия ключевых аминокислотных радикалов, которые производят структурные различия, препятствующие ключевым взаимодействиям, необходимым для активности ИСП.
Дендротоксины – основные белки, имеющие положительный заряд при нейтральном pH. Большинство положительно заряженных радикалов аминокислот находятся в нижней части структуры, создавая катионную область в одной части белка. Положительный заряд исходит от радикалов лизина(Lys) и аргинина(Arg), которые сконцентрированы на трёх основных участках: вблизи амино-конца (Arg3, Arg4, Lys5), вблизи C-конца (Arg54, Arg55) и узкой области β-оборота (Lys28, Lys29, Lys30)[3]. Полагают, что эти положительно заряженные радикалы могут играть критичную роль в связывающей активности дендротоксинов, так как они могут взаимодействовать с анионными участками (отрицательно заряженными аминокислотами) в порах калиевых каналов.
Биологическая активность
Механизм действия
Одна молекула дендротоксина обратимо связывается с калиевым каналом для того, чтобы оказать ингибирующий эффект. Предполагается что это взаимодействие инициируется электростатическими взаимодействиями между положительно заряженными радикалами аминокислот в катионной области дендротоксина и отрицательно заряженными радикалами в порах ионных каналов. Калиевые каналы, как и другие катионно-избирательные каналы, предположительно имеют облако отрицательных зарядов, находящихся перед входным отверстием в пору канала, которое помогает проводить ионы калия по пути проникновения. Обычно считается (но не доказано), что молекулы дендротоксина связываются с анионными связями вблизи внеклеточной поверхности канала и физически закрывают пору, тем самым предотвращая проведение ионов. Однако, Имреди и МакКиннон[4] предположили, что дельта-дендротоксин может иметь отклонённое от центра место связывания на целевых белках, и может ингибировать канал путём изменения его структуры, а не физического блокирования пор.
Биологически важные радикалы
Многие исследования были направлены на определение радикалов аминокислот, необходимых для связывающего действия дендротоксинов на целевые калиевые каналы. Харви и другие учёные[5] использовали особые модификации, направленные на радикалы, для определения положительно заряженных радикалов, имеющих решающее значение для блокирующей активности l-дендротоксина. Они сообщили, что ацетилирование Lys5 вблизи области амино-конца и Lys29 вблизи области β-оборота, привело к существенному уменьшению сходства связывания l-дендротоксина. Похожие результаты были получены для K-дендротоксина при использовании мутагенеза для замены положительно заряженных остатков лизина и аргинина на нейтральные аланины. Эти результаты, наряду со многими другими, предположительно показали, что положительно заряженные радикалы лизина в половине амино-конца, в частности, Lys5 в спирали 310, играют очень важную роль в связывании дендротоксина с целевыми калиевыми каналами. Остатки лизина в области β-оборота предоставили более смешанные результаты, по всей видимости, являясь биологически критическим в некоторых гомологах дендротоксина и не обязательными для других. Кроме того, мутация всей тройки лизина (К28-К29-К30) в Ala-Ala-Gly в α-дендротоксине привело к очень незначительным изменениям биологической активности.
Существует общее мнение, что сохраняющийся лизиновый радикал вблизи амино-конца (Lys5 в α-дендротоксине) имеет решающее значение для биологической активности всех дендротоксинов, в то время как дополнительные радикалы, такие как в области β-оборота могут играть роль в специфичности дендротоксина путем опосредования взаимодействий отдельных токсинов на их отдельные целевые области. Это не только помогает объяснить жёсткую специфичность некоторых дендротоксинов для различных подтипов потенциалозависимых каналов K+, но также объясняет различия в силе действия дендротоксинов на обычные каналы K+. Например, Ван и другие учёные [6] показали, что взаимодействие K-дендротоксина с KV1.1 обеспечивается с помощью его радикалов лизина как в амино-конце, так и в области β-оборота, в то время как α-дендротоксин-видимому, взаимодействует с его мишенью исключительно за счет амино-конца. Эта менее обширная взаимодействующая область может помочь объяснить, почему α-дендротоксин менее различающий в то время как K-дендротоксин строго избирателен по отношению к KV1.1.
Использование в исследованиях
Калиевые каналы нейронов позвоночных имеют множество разновидностей, позволяющих им подстраивать свойства их электрических сигналов проявлением различных комбинаций подгрупп калиевых каналов. К тому же, так как они регулируют движения ионов через биологические мембраны, они являются важными во многих аспектах клеточной регуляции и передаче сигналов разных типов клеток. Следовательно, потенциалозависимые калиевые каналы являются целями для широкого спектра сильнодействующих биологических токсинов таких животных, как змеи, скорпионы, актинии и конических улиток. Так, очищение яда привело к выделению пептидных токсинов, таких, как дендротоксин, которые стали полезными фармакологическими инструментами для изучения калиевых каналов. В связи с их активностью и избирательностью к различным подтипам калиевых каналов, дендротоксины стали пригодными к использованию в качестве молекулярных зондов для структурного и функционального анализа этих белков. Это может помочь пониманию ролей, играемых отдельными типами каналов, а также помочь классифицированию разнообразных типов каналов[7]. Кроме того, наличие меченых радиоактивными изотопами дендротоксинов предоставляет инструмент для изучения других источников в поисках новых токсинов, действующих на калиевые каналы, таких как класс каликлудинов, присутствующих в актиниях. И, наконец, структурная информация, представленная дендротоксином может дать ключ к синтезу лекарственных соединений, которые могут воздействовать на определенные классы калиевых каналов
Примечания
- ↑ Gasparini S., Danse J. M., Lecoq A., Pinkasfeld S., Zinn-Justin S., Young L. C., de Medeiros C. C., Rowan E. G., Harvey A. L., Ménez A. Delineation of the functional site of alpha-dendrotoxin. The functional topographies of dendrotoxins are different but share a conserved core with those of other Kv1 potassium channel-blocking toxins. (англ.) // The Journal of biological chemistry. — 1998. — Vol. 273, no. 39. — P. 25393—25403. — PMID 9738007.
- ↑ Katoh E., Nishio H., Inui T., Nishiuchi Y., Kimura T., Sakakibara S., Yamazaki T. Structural basis for the biological activity of dendrotoxin-I, a potent potassium channel blocker. (англ.) // Biopolymers. — 2000. — Vol. 54, no. 1. — P. 44—57. — DOI:10.1002/(SICI)1097-0282(200007)54:1<44::AID-BIP50>3.0.CO;2-Z. — PMID 10799980.
- ↑ Swaminathan P., Hariharan M., Murali R., Singh C. U. Molecular structure, conformational analysis, and structure-activity studies of Dendrotoxin and its homologues using molecular mechanics and molecular dynamics techniques. (англ.) // Journal of medicinal chemistry. — 1996. — Vol. 39, no. 11. — P. 2141—2155. — DOI:10.1021/jm950579p. — PMID 8667358.
- ↑ Imredy J. P., MacKinnon R. Energetic and structural interactions between delta-dendrotoxin and a voltage-gated potassium channel. (англ.) // Journal of molecular biology. — 2000. — Vol. 296, no. 5. — P. 1283—1294. — DOI:10.1006/jmbi.2000.3522. — PMID 10698633.
- ↑ Harvey A. L., Rowan E. G., Vatanpour H., Engström A., Westerlund B., Karlsson E. Changes to biological activity following acetylation of dendrotoxin I from Dendroaspis polylepis (black mamba). (англ.) // Toxicon : official journal of the International Society on Toxinology. — 1997. — Vol. 35, no. 8. — P. 1263—1273. — PMID 9278975.
- ↑ Wang F. C., Bell N., Reid P., Smith L. A., McIntosh P., Robertson B., Dolly J. O. Identification of residues in dendrotoxin K responsible for its discrimination between neuronal K+ channels containing Kv1.1 and 1.2 alpha subunits. (англ.) // European journal of biochemistry / FEBS. — 1999. — Vol. 263, no. 1. — P. 222—229. — PMID 10429207.
- ↑ Yoshida S., Matsumoto S. Effects of alpha-dendrotoxin on K+ currents and action potentials in tetrodotoxin-resistant adult rat trigeminal ganglion neurons. (англ.) // The Journal of pharmacology and experimental therapeutics. — 2005. — Vol. 314, no. 1. — P. 437—445. — DOI:10.1124/jpet.105.084988. — PMID 15831438.
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .