| Флюориназа (аденозил-фторид синтаза) | |
|---|---|
 | |
| Идентификаторы | |
| Шифр КФ | 2.5.1.63 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
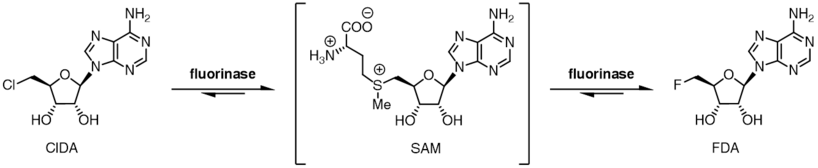
Флюориназа (КФ 2.5.1.63, аденозил-фтор-синтетаза) — фермент, катализирующий реакцию между фторид аниониом и S-аденозил-L-метионином, в результате которой образуются L-метионин и 5'-фтор-5'-дезоксиаденозин. 5'-фтор-5'-дезоксиаденозин является первым фторорганическим соединением и лежит в основе биосинтеза фторсодержащих органических соединений в живых организмах.[1] Флюориназа впервые была выделена из почвенных бактерий Streptomyces cattleya. Позднее гомологи данного белка были выявлены в ряде других видов, в частности в Streptomyces sp. MA37, Nocardia brasiliensis и Actinoplanes sp. N902-109.[2] На сегодняшний день флюориназа является единственный ферментом, способным катализировать образование связей между фтором и углеродом (самые прочные химические связи в органической химии).[3]

В 2007 году из актиномицета Salinospora tropica был выделен гомологичный флюориназе фермент — хлориназа, обеспечивающий введение хлора в органичеческие соединения за счет образования связи углерод-хлор. Хлориназа принимает участие в биосинтезе салиноспорамида А.[4]
Активность
Флюориназа катализирует реакцию бимолекулярного нуклеофильного замещения (SN2) по С-5' положению S-аденозил-метионина, в то время как L-метионин выступает в качестве нейтральной уходящей группы.[5][6] Скорость реакции в присутствии флюориназы увеличивается 106 −1015[7] раз, по сравнению с реакцией протекающей без катализатора. Тем не менее, флюориназа считается медленным фермент, с числом оборотов (kкат) в 0,06 мин−1.[8] Большое значение кинетического барьера данной реакции объясняется сильной гидратацией фторид анионов, в связи с этим образование связи углерод-фтор имеет высокие значения энергии активации. При этом, значительная доля энергии необходима на «зачистку» фторид анионов от связанных с ним молекул воды; в результате этого из фторида в активном центре фермента образуется сильный нуклеофил, атакующий субстрат.
Реакция катализируемая флюориназой обратима, и после инкубации 5'-фтор-5'-дезоксиаденозина и L-метионина с флюориназой образуется S-аденозил-L-метионин и фторид анион.[9] Замещение L-метионина на L-селенометионин приводит к 6-ти кратному увеличению скорости обратной реакции, что обусловлено увеличением нуклеофильности в результате замены серы на селен.
Флюориназа обладает относительно невысокой селективностью в отношении галогенид анионов, так фермент способен катализировать присоединение хлорид аниона. Хотя равновесие реакции между S-аденозил-L-метионином и фторид анионом сдвинуто в сторону продуктов, в аналогичной реакции с хлорид анионом равновесие сдвинуто в сторону исходных веществ. Инкубация S-аденозил-L-метионина и хлорид анионов в среде содержащей флюориназу не приводит к образованию 5'-хлоро-5'-дезоксиаденозина, до тех пор пока не будет добавлена оксидаза L-аминокислот. Значение оксидазы L-аминокислот состоит в окислении L-метионина до соответствующей оксокислоты. Уменьшение концентрации продукта первой реакции (L-метионина) приводит к сдвигу равновесия по принципу Ле Шателье и образованию 5'-хлоро-5'-дезоксиаденозина.

Невысокая специфичность в отношении галогенид анионов и различное положение равновесия в реакциях введения фтора и хлора обеспечивает возможность реакции трансгалогенирования (замены хлора на фтор). Инкубирование 5'-хлоронуклеозидов с ферментом и каталитическими количествами L-селенометионина или L-метионина приводит к образованию 5'-фторонуклеозидов. При введении в реакционную среду анионов изотопа 18F, реакция трансгалогенирования может быть использована для получения радиопрепаратов, которые активно применяются в позитронно-эмиссионной томографии.[10][11]
Структурные исследования
С 2007 года, 9 структур были определены для этого класса ферментов. В базе данных белковых структур (PDB) данным белкам соответствуют следующие коды: Шаблон:PDB link, Шаблон:PDB link, Шаблон:PDB link, Шаблон:PDB link, Шаблон:PDB link, Шаблон:PDB link, Шаблон:PDB link, Шаблон:PDB link, и Шаблон:PDB link.
Название фермента обусловлено функцией. Структурно флюориназа гомологична duf-62 типу ферментов. Фермент представляет собой димер из тримеров (2 молекулы каждая из трех субъединиц). Активные центры находятся между этими субъединицами (интейрфейс субъединиц); в каждом сайте может связываться одна молекула .[12]
Биосинтез фторметаболитов
См. также
Примечания
- ↑ O'Hagan, David; Schaffrath, Christoph; Cobb, Steven L.; Hamilton, John T. G.; Murphy, Cormac D. (March 2002). “Biochemistry: Biosynthesis of an organofluorine molecule”. Nature. 416 (6878): 279—279. DOI:10.1038/416279a. PMID 11907567.
- ↑ Deng, Hai (2014-02-10). “Identification of Fluorinases from Streptomyces sp MA37, Norcardia brasiliensis, and Actinoplanes sp N902-109 by Genome Mining”. ChemBioChem. 15 (3): 364—368. DOI:10.1002/cbic.201300732. ISSN 1439-7633.
- ↑ O'Hagan, David (February 2008). “Understanding organofluorine chemistry. An introduction to the C–F bond”. Chem. Soc. Rev. 37 (2): 308—319. DOI:10.1039/b711844a. PMID 18197347.
- ↑ Eustáquio, Alessandra S. “Discovery and characterization of a marine bacterial SAM-dependent chlorinase”. Nature Chemical Biology. 4 (1): 69—74. DOI:10.1038/nchembio.2007.56. PMID 18059261.
- ↑ Cadicamo, Cosimo D. (2004-05-03). “Enzymatic Fluorination in Streptomyces cattleya Takes Place with an Inversion of Configuration Consistent with an SN2 Reaction Mechanism”. ChemBioChem. 5 (5): 685—690. DOI:10.1002/cbic.200300839. ISSN 1439-7633.
- ↑ Senn, Hans Martin; O'Hagan, David; Thiel, Walter (2005-10-01). “Insight into Enzymatic C−F Bond Formation from QM and QM/MM Calculations”. Journal of the American Chemical Society. 127 (39): 13643—13655. DOI:10.1021/ja053875s. ISSN 0002-7863. PMID 16190730.
- ↑ Lohman, Danielle C. (2013-10-02). “Catalysis by Desolvation: The Catalytic Prowess of SAM-Dependent Halide-Alkylating Enzymes”. Journal of the American Chemical Society. 135 (39): 14473—14475. DOI:10.1021/ja406381b. ISSN 0002-7863. PMID 24041082.
- ↑ Zhu, Xiaofeng (2007-11-01). “Mechanism of Enzymatic Fluorination in Streptomyces cattleya”. Journal of the American Chemical Society. 129 (47): 14597—14604. DOI:10.1021/ja0731569. ISSN 0002-7863. PMID 17985882.
- ↑ Deng, Hai; Cobb, Steven L.; McEwan, Andrew R.; McGlinchey, Ryan P.; Naismith, James H.; O'Hagan, David; Robinson, David A.; Spencer, Jonathan B. (2006-01-23). “The Fluorinase from Streptomyces cattleya Is Also a Chlorinase”. Angewandte Chemie International Edition. 45 (5): 759—762. DOI:10.1002/anie.200503582. ISSN 1521-3773. PMC 3314195. PMID 16370017.
- ↑ Deng, Hai. “Fluorinase mediated C–18F bond formation, an enzymatic tool for PET labelling”. Chemical Communications (6): 652. DOI:10.1039/b516861a.
- ↑ Thompson, S.; Onega, M.; Ashworth, S.; Fleming, I. N.; Passchier, J.; O'Hagan, D. “A two-step fluorinase enzyme mediated 18 F labelling of an RGD peptide for positron emission tomography”. Chem. Commun. 51 (70): 13542—13545. DOI:10.1039/c5cc05013h.
- ↑ Dong, C (2004). “Crystal Structure and Mechanism of a Bacterial Flourinating Enzyme”. Nature Chemistry. 427: 561—565. DOI:10.1038/nature02280. PMID 14765200. Параметры
|author=и|last=дублируют друг друга (справка)
Литература
- “Biochemistry: biosynthesis of an organofluorine molecule”. Nature. 416 (6878): 279. 2002. DOI:10.1038/416279a. PMID 11907567.
- Naismith JH (2004). “Crystal structure and mechanism of a bacterial fluorinating enzyme”. Nature. 427 (6974): 561–, 5. DOI:10.1038/nature02280. PMID 14765200. Параметры
|author=и|last=дублируют друг друга (справка)
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .