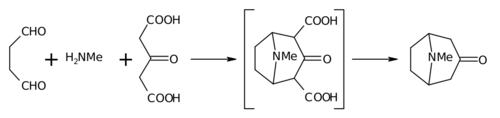
Реакция Робинсона-Шепфа — метод синтеза тропинонов и их гомологов конденсацией дикарбонильных соединений с ацетондикарбоновой кислотой и первичными аминами.
Разработан Робинсоном в 1917 г. как метод синтеза тропинона конденсацией диальдегида янтарной кислоты с ацетондикарбоновой кислотой и метиламином[1] в рамках его работ по механизмам синтеза алкалоидов тропанового ряда[2]:
Метод модифицирован в 1937 г. Шепфом[3].
Механизм
Реакция Робинсона-Шепфа является модификацией реакции Манниха, в которой циклическая иминиевая соль, образующаяся из янтарного диальдегида, алкилирует енольную форму ацетондикарбоновой кислоты:
На первой стадии происходит конденсация альдегида с амином с образованием шиффова основания (1), которое затем претерпевает циклоконденсацию в иминиевую соль (2).
Иминиевая соль, в свою очередь, атакует C-нуклеофильный центр енола ацетондикарбоновой кислоты с образованием основания Манниха (3).
2-Гидроксипиррольный фрагмент основания Манниха затем дегидратируется с образованием иминиевой соли (4), после чего происходит внутримолекулярная конденсация Манниха, в которой C-электрофильный иминиевый фрагмент атакует C-нуклеофильный центр енола (5) с замыканием пиперидинового фрагмента тропана.
Модификации
В первоначальном варианте, описанном Робинсоном, реакция проводилась в присутствии щелочи, выходы при этом были невелики, ~20 %, однако Шепф модифицировал условия реакции, проводя синтез в условиях, близких к физиологическим — при комнатной температуре и в присутствии буфера (при pH ~5.5).
В современном варианте реакцию обычно проводят в водном растворе, при этом к раствору смеси ацетондикарбоновой кислоты и амина, буферизованном дигидрофосфатом или цитратом натрия, прибавляют раствор диальдегида или другого дикарбонильного соединения, после чего реакционную смесь выдерживают при комнатной температуре[4]. При необходимости декарбоксилирования первоначального продукта конденсации, реакционную смесь подкисляют соляной кислотой и проводят декарбоксилирование нагревом на паровой бане. В этих условиях выходы достигают 50-90 %[5],[4].
Реакция идет и при использовании гомологов янтарного диальдегида, при этом образуются гомологи тропинона, так, используя глутарового альдегида вместо янтарного, Мензис и Робинсон синтезировали алкалоид граната псевдопельтьерин[6].
В качестве синтетических аналогов дикарбонильных соединений могут использоваться их циклические ацетали — 2,5-диалкокситетрагидро- и 2,5-алкоксидигидрофураны вместо янтарного диальдегида и его гидроксипроизводного[7],[8] 2-этокси-3,4-дигидро-2H-пиран[5] и т. п.
При проведении реакции с ацетондикарбоновой кислотой, как правило, происходит декарбоксилирование промежуточно образующихся при замыкании цикла дикарбоксильных производных, для сохранения карбоксильных фрагментов применяют защиту карбоксильных групп, вводя в реакцию эфиры ацетондикарбоновой кислоты. Так, например, при синтезе 2-карбометокситропинона, предшественника метилового эфира экгонина, использующегося в полном синтезе кокаина, в реакцию вводят моноэфир ацетондикарбоновой кислоты[4].
Синтетическое значение
Реакция Робинсона-Шепфа является первым примером сочетания ретросинтетического анализа и биомиметического подхода в планировании органического синтеза. Исследуя возможные пути биосинтеза тропановых алкалоидов, Робинсон, проанализировав структуру тропинона, пришел к выводу, что его «воображаемый гидролиз» может идти с образованием янтарного диальдегида, метиламина и ацетона — и предположил, что стратегия синтеза может быть обратной по отношению к «воображаемому гидролизу» — а именно, конденсацией этих фрагментов[1].
Эта гипотеза нашла блестящее экспериментальное подтверждение — используя ацетондикарбоновую кислоту как синтетический єквивалент ацетона с повышенной нуклеофильностью метиленовых групп, Робинсон синтезировал тропинон, ключевой предшественник в синтезе экгонина — структурной основы тропановых алкалоидов. Сама методика Робинсона — проведение одностадийного синтеза, в ходе которого осуществляется последовательность нескольких реакций, ведущих к хорошему выходу целевого продукта, в дальнейшем получила название one-pot synthesis.
Реакция используется как метод синтеза полициклических гетероциклов (аминодиальдегиды), пиперидинового цикла (при использовании глутарового альдегида — синтезы лобеланина[9], пиперидонов[10], оксазолопиперидинов и дальнейшего синтеза из них кониина[11],[12] гидроазуленов[13], беталаинов[14].
Примечания
- 1 2 Robinson, Robert (1917-01-01). “LXIII.—A synthesis of tropinone”. J. Chem. Soc., Trans. 111 (0): 762—768. DOI:10.1039/CT9171100762. ISSN 0368-1645. Проверено 2015-12-16.
- ↑ Robinson, Robert (1917-01-01). “LXXV.—A theory of the mechanism of the phytochemical synthesis of certain alkaloids”. J. Chem. Soc., Trans. 111 (0): 876—899. DOI:10.1039/CT9171100876. ISSN 0368-1645. Проверено 2015-12-16.
- ↑ C. Schöpf, Angew. Chem. 50, 779, 797 (1937)
- 1 2 3 Casale, John F. (1987-01-01). “A practical total synthesis of cocaine's enantiomers”. Forensic Science International. 33 (4): 275—298. DOI:10.1016/0379-0738(87)90109-5. ISSN 0379-0738. Проверено 2015-12-23.
- 1 2 “PSEUDOPELLETIERINE”. Organic Syntheses. 37: 73. 1957. DOI:10.15227/orgsyn.037.0073. ISSN 23333553 00786209, 23333553 Проверьте параметр
|issn=(справка на английском). Проверено 2015-12-17. - ↑ Menzies, Robert Charles; Robinson, Robert (1924-01-01). “CCLXXXVI.—A synthesis of ψ-pelletierine”. J. Chem. Soc., Trans. 125 (0): 2163—2168. DOI:10.1039/CT9242502163. ISSN 0368-1645. Проверено 2015-12-17.
- ↑ N. Elming, in R. A. Raphael, E. C. Taylor, and H. Wynberg, "Advances in Organic Chemistry, " Vol. 2, 1960, pp. 67-115.
- ↑ The Alkaloids: Chemistry and Pharmacology V33: Chemistry and Pharmacology. — Academic Press, 1988-08-01. — P. 33-34. — ISBN 978-0-08-086557-7.
- ↑ Wieland H, Schopf C, Hermsen W. Liebigs Ann. Chem. 1925;444:40-68
- ↑ Langlois, Michel; Yang, Donglaï; Soulier, Jean-Louis; Florac, Claudie (1992). “Synthesis of Derivatives of 1, 2, 6-Trisubstttuted-4-Piperidones”. Synthetic communications. 22 (21): 3115—3127.
- ↑ Rubiralta, M. Piperidine: Structure, Preparation, Reactivity, and Synthetic Applications of Piperidine and its Derivatives / M. Rubiralta, Giralt, Diez. — Elsevier, 2013-10-22. — P. 272. — ISBN 978-1-4832-9093-5.
- ↑ Guerrier, Luc; Royer, Jacques; Grierson, David S.; Husson, Henri Philippe (1983). “Chiral 1,4-dihydropyridine equivalents: a new approach to the asymmetric synthesis of alkaloids. The enantiospecific synthesis of (+)- and (-)-coniine and dihydropinidine”. Journal of the American Chemical Society. 105 (26): 7754—7755. DOI:10.1021/ja00364a053. ISSN 0002-7863. Проверено 2015-12-17.
- ↑ Chapman, O. L.; Koch, T. H. (1966). “A Synthetic Entry to the Hydroazulenes. 4,5-Trimethylenetropone”. The Journal of Organic Chemistry. 31 (4): 1042—1045. DOI:10.1021/jo01342a013. ISSN 0022-3263. Проверено 2015-12-17.
- ↑ Buchi, George; Fliri, Hans; Shapiro, Rafael (1978). “Synthesis of betalains”. The Journal of Organic Chemistry. 43 (25): 4765—4769. DOI:10.1021/jo00419a013. ISSN 0022-3263. Проверено 2015-12-17.
| Это заготовка статьи по органической химии. Вы можете помочь проекту, дополнив её. |
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .