
Конденсины — большие белковые комплексы, которые играют главную роль в расхождении хромосом во время митоза и мейоза[1][2].
Субъединичный состав
Эукариотические конденсины

Большинство эукариотических клеток имеют два вида конденсиновых комплексов, которые называются конденсин I и конденсин II. Каждый из них состоит из пяти субъединиц[3][4]. Конденсины I и II имеют общую пару субъединиц, SMC2 и SMC4, которые принадлежат к большому семейству хромосомных АТФаз, известному как SMC-белки (англ. Structural Maintenance of Chromosomes). Каждый из этих комплексов содержит определённый набор регуляторных субъединиц (кляйзиновую субъединицу[5] и пару субъединиц с HEAT-повторами[6]). У нематоды Caenorhabditis elegans есть третий конденсиновый комплекс (родственный конденсину I), который участвует в дозовой компенсации[7]. Этот комплекс называется конденсин IDC, и в нём субъединица SMC4 заменена на схожий белок DPY-27.
| Комплекс | Субъединица | Класс | S. cerevisiae | S. pombe | C. elegans | D. melanogaster | Позвоночные (гены человека) |
|---|---|---|---|---|---|---|---|
| конденсин I и II | SMC2 | АТФаза | Smc2 | Cut14 | MIX-1 | DmSmc2 | CAP-E (SMC2) |
| конденсин I и II | SMC4 | АТФаза | Smc4 | Cut3 | SMC-4 | DmSmc4 | CAP-C (SMC4) |
| конденсин I | CAP-D2 | HEAT | Ycs4 | Cnd1 | DPY-28 | CG1911 | CAP-D2 (NCAPD2) |
| конденсин I | CAP-G | HEAT | Ycg1 | Cnd3 | CAP-G1 | cap-g | CAP-G (NCAPG) |
| конденсин I | CAP-H | kleisin | Brn1 | Cnd2 | DPY-26 | barren | CAP-H (NCAPH) |
| конденсин II | CAP-D3 | HEAT | - | - | HCP-6 | CG31989 | CAP-D3 (NCAPD3) |
| конденсин II | CAP-G2 | HEAT | - | - | CAP-G2 | -? | CAP-G2 (NCAPG2) |
| конденсин II | CAP-H2 | kleisin | - | - | KLE-2 | CG14685 | CAP-H2 (NCAPH2) |
| конденсин IDC | DPY-27 | АТФаза | - | - | DPY-27 | - | - |
Структура и функции конденсина I неизменны от дрожжей к человеку, но у дрожжей нет конденсина II[8][9]. По всей видимости нет никакой связи между наличием у эукариотического организма конденсина II и размером его генома. Напротив, у примитивной красной водоросли Cyanidioschyzon merolae есть конденсины I и II, хотя размер её генома мал даже по сравнению с дрожжами[10].
Прокариотические конденсины
У прокариот есть конденсин-подобные комплексы, которые также обеспечивают организацию и расхождение хромосом. Прокариотические конденсины можно разделить на два типа: SMC-ScpAB[11] и MukBEF[12]. У большинства видов эубактерий и архей присутствуют конденсины SMC-ScpAB, а у γ-протеобактерий — MukBEF.
| Комплекс | Субъединица | Классификация | B. subtilis | Caulobacter | E.coli |
|---|---|---|---|---|---|
| SMC-ScpAB | SMC | АТФаза | SMC/BsSMC | SMC | - |
| SMC-ScpAB | ScpA | kleisin | ScpA | ScpA | - |
| SMC-ScpAB | ScpB | winged-helix | ScpB | ScpB | - |
| MukBEF | MukB | АТФаза | - | - | MukB |
| MukBEF | MukE | ? | - | - | MukE |
| MukBEF | MukF | kleisin | - | - | MukF |
Механизм действия
Одиночное конденсиновое кольцо окружает два участка двухцепочечной ДНК, а затем замыкается при помощи дополнительных не SMC субъединиц. Таким образом эти белки обеспечивают конденсацию хроматина, образование петель и правильную укладку ДНК в хроматиде.
Активность
Очиненный конденсин I использует энергию АТФ, что бы создавать на ДНК положительные супервитки[13]. Он проявляет ДНК-зависимую АТФазную активность in vitro. Димер SMC2-SMC4 способен ренатурировать комплементарную одноцепочечную ДНК[14]. Для этой активности ему не требуется АТФ.
Структура
Димеры SMC, которые являются центральными субъединицами конденсинов, имеют уникальную V-образную форму[15]. Такую форму удалось определить у конденсина I с помощью электронной микроскопии[16].
Функции в митозе
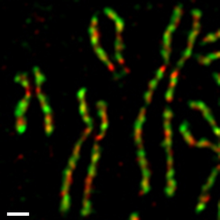
В культивируемых клетках человека конденсиновые комплексы I и II неодинаково ведут себя в процессе прохождения клеточного цикла[17][18]. В течение интерфазы конденсин II находится в ядре и принимает участие в начальных стадиях конденсации хромосом во время профазы. Конденсин I, напротив, в течение интерфазы находится в цитоплазме, попадает к хромосомам только после исчезновения ядерной оболочки в конце профазы. В течение прометафазы и метафазы, оба конденсина участвуют в конденсации хромосом, в результате которой сестринские хроматиды полностью оформляются[4]. Оба комплекса, по-видимому, остаются связанными с хромосомами даже после расхождения сестринских хроматид в анафазе. По крайней мере, одна субъединица конденсина I напрямую взаимодействует с циклин-зависимой киназой (Cdk)[19].
Другие функции
Недавние исследования показали, что конденсины участвуют в широком спектре процессов, происходящих в хромосомах вне митоза и мейоза. У почкующихся дрожжей, например, конденсин I (единственный конденсин этого организма) помогает в регуляции числа копий тандемных повторов рибосомной ДНК[20], а также в кластеризации генов тРНК[21]. У дрозофилы субъединицы конденсина II участвуют в растворении политенных хромосом[22] и формировании хромосомной территории[23] в питающих клетках. Также существуют доказательства, что они осуществляют негативную регуляцию при генетической трансвекции диплоидных клеток. У A. thaliana конденсин II необходим для формирования устойчивости растения к бору, возможно, он предотвращает повреждение ДНК[24]. Было показано, что в клетках человека конденсин II инициирует события, связанные с расхождением сестринских хроматид в митозе, уже во время S-фазы митотического цикла[25].
Родственные белки
В клетках эукариот есть два дополнительных класса комплексов из SMC-белков, это когезины, которые содержат SMC1 и SMC3 и участвуют в связывании сестринских хроматид, а также комплекс SMC5/6, который содержит SMC5 и SMC6, он участвует в рекомбинационной репарации.
См. также
Примечания
- ↑ Hirano T (2012). “Condensins: universal organizers of chromosomes with diverse functions”. Genes Dev. 26 (15): 1659—1678. DOI:10.1101/gad.194746.112. PMC 3418584. PMID 22855829.
- ↑ Wood AJ, Severson AF, Meyer BJ (2010). “Condensin and cohesin complexity: the expanding repertoire of functions”. Nat Rev Genet. 11 (6): 391—404. DOI:10.1038/nrg2794. PMC 3491780. PMID 20442714.
- ↑ Hirano T, Kobayashi R, Hirano M. (1997). “конденсинs, chromosome condensation complex containing XCAP-C, XCAP-E and a Xenopus homolog of the Drosophila Barren protein”. Cell. 89 (4): 511—21. DOI:10.1016/S0092-8674(00)80233-0. PMID 9160743.
- 1 2 Ono T, Losada A, Hirano M, Myers MP, Neuwald AF, Hirano T. (2003). “Differential contributions of конденсин I and конденсин II to mitotic chromosome architecture in vertebrate cells”. Cell. 115 (1): 109—21. DOI:10.1016/S0092-8674(03)00724-4. PMID 14532007.
- ↑ Schleiffer A, Kaitna S, Maurer-Stroh S, Glotzer M, Nasmyth K, Eisenhaber F. (2003). “Kleisins: a superfamily of bacterial and eukaryotic SMC protein partners”. Mol. Cell. 11 (3): 571—5. DOI:10.1016/S1097-2765(03)00108-4. PMID 12667442.
- ↑ Neuwald AF, Hirano T. (2000). “HEAT repeats associated with condensins, cohesins, and other complexes involved in chromosome-related functions”. Genome Res. 10 (10): 1445—52. DOI:10.1101/gr.147400. PMID 11042144.
- ↑ Csankovszki G, Collette K, Spahl K, Carey J, Snyder M, Petty E, Patel U, Tabuchi T, Liu H, McLeod I, Thompson J, Sarkeshik A, Yates J, Meyer BJ, Hagstrom K. (2009). “Three distinct condensin complexes control C. elegans chromosome dynamics”. Curr. Biol. 19 (1): 9—19. DOI:10.1016/j.cub.2008.12.006. PMID 19119011.
- ↑ Sutani T, Yuasa T, Tomonaga T, Dohmae N, Takio K, Yanagida M. (1999). “Fission yeast конденсин complex: essential roles of non-SMC subunits for condensation and Cdc2 phosphorylation of Cut3/SMC4”. Genes Dev. 13 (17): 2271—83. DOI:10.1101/gad.13.17.2271. PMID 10485849.
- ↑ Freeman L, Aragon-Alcaide L, Strunnikov A. (2000). “The конденсин complex governs chromosome condensation and mitotic transmission of rDNA”. J. Cell Biol. 149 (4): 811—824. DOI:10.1083/jcb.149.4.811. PMID 10811823.
- ↑ Fujiwara T, Tanaka K, Kuroiwa T, Hirano T. (2013). “Spatiotemporal dynamics of конденсинs I and II: evolutionary insights from the primitive red alga Cyanidioschyzon merolae”. Mol. Biol. Cell. 24 (16): 2515—27. DOI:10.1091/mbc.E13-04-0208. PMID 23783031.
- ↑ Mascarenhas J, Soppa J, Strunnikov AV, Graumann PL. (2002). “Cell cycle-dependent localization of two novel prokaryotic chromosome segregation and condensation proteins in Bacillus subtilis that interact with SMC protein”. EMBO J. 21 (12): 3108—18. DOI:10.1093/emboj/cdf314. PMID 12065423.
- ↑ Yamazoe M, Onogi T, Sunako Y, Niki H, Yamanaka K, Ichimura T, Hiraga S. (1999). “Complex formation of MukB, MukE and MukF proteins involved in chromosome partitioning in Escherichia coli”. EMBO J. 18 (21): 5873—84. DOI:10.1093/emboj/18.21.5873. PMID 10545099.
- ↑ Kimura K, Hirano T. (1997). “ATP-dependent positive supercoiling of DNA by 13S condensin: a biochemical implication for chromosome condensation”. Cell. 90 (4): 625—634. DOI:10.1016/s0092-8674(00)80524-3. PMID 9288743.
- ↑ Sutani T, Yanagida M. (1997). “DNA renaturation activity of the SMC complex implicated in chromosome condensation”. Nature. 388 (6644): 798—801. DOI:10.1038/42062. PMID 9285594.
- ↑ Melby TE, Ciampaglio CN, Briscoe G, Erickson HP. (1998). “The symmetrical structure of structural maintenance of chromosomes (SMC) and MukB proteins: long, antiparallel coiled coils, folded at a flexible hinge”. J. Cell Biol. 142 (6): 1595—1604. DOI:10.1083/jcb.142.6.1595. PMID 9744887.
- ↑ Anderson DE, Losada A, Erickson HP, Hirano T. (2002). “Condensin and cohesin display different arm conformations with characteristic hinge angles”. J. Cell Biol. 156 (6): 419—424. DOI:10.1083/jcb.200111002. PMID 11815634.
- ↑ Ono T, Fang Y, Spector DL, Hirano T (2004). “Spatial and temporal regulation of Condensins I and II in mitotic chromosome assembly in human cells”. Mol. Biol. Cell. 15 (7): 3296—308. DOI:10.1091/mbc.E04-03-0242. PMID 15146063.
- ↑ Hirota T, Gerlich D, Koch B, Ellenberg J, Peters JM (2004). “Distinct functions of condensin I and II in mitotic chromosome assembly”. J. Cell Sci. 117 (Pt 26): 6435—45. DOI:10.1242/jcs.01604. PMID 15572404.
- ↑ Kimura K, Hirano M, Kobayashi R, Hirano T (1998). “Phosphorylation and activation of 13S condensin by Cdc2 in vitro”. Science. 282 (5388): 487—490. DOI:10.1126/science.282.5388.487. PMID 9774278.
- ↑ Johzuka K, Terasawa M, Ogawa H, Ogawa T, Horiuchi T (2006). “Condensin loaded onto the replication fork barrier site in the rRNA gene repeats during S phase in a FOB1-dependent fashion to prevent contraction of a long repetitive array in Saccharomyces cerevisiae”. Mol Cell Biol. 26 (6): 2226—2236. DOI:10.1128/MCB.26.6.2226-2236.2006. PMID 16507999.
- ↑ Haeusler RA, Pratt-Hyatt M, Good PD, Gipson TA, Engelke DR (2008). “Clustering of yeast tRNA genes is mediated by specific association of condensin with tRNA gene transcription complexes”. Genes Dev. 22 (16): 2204—2214. DOI:10.1101/gad.1675908. PMID 18708579.
- ↑ Hartl TA, Smith HF, Bosco G (2008). “Chromosome alignment and transvection are antagonized by condensin II”. Science. 322 (5906): 1384—1387. DOI:10.1126/science.1164216. PMID 19039137.
- ↑ Bauer CR, Hartl TA, Bosco G. (2012). “Condensin II promotes the formation of chromosome territories by inducing axial compaction of polyploid interphase chromosomes”. PLoS Genet. 8 (8): e1002873. DOI:10.1371/journal.pgen.1002873. PMID 22956908.
- ↑ Sakamoto T, Inui YT, Uraguchi S, Yoshizumi T, Matsunaga S, Mastui M, Umeda M, Fukui K, Fujiwara T. (2011). “Condensin II alleviates DNA damage and is essential for tolerance of boron overload stress in Arabidopsis”. Plant cell. 23 (9): 3533—3546. DOI:10.1105/tpc.111.086314. PMID 21917552.
- ↑ Ono T, Yamashita D, Hirano T (2013). “Condensin II initiates sister chromatid resolution during S phase”. J. Cell Biol. 200 (4): 429—441. DOI:10.1083/jcb.201208008. PMID 23401001.
Внешние ссылки
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .
