
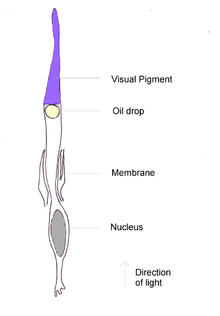
Зрение является наиболее важным чувством для птиц, поскольку хорошее зрение необходимо для безопасного полёта. В отличие от других позвоночных среди них отсутствуют виды с редуцированными глазами. У птиц имеется ряд приспособлений, обеспечивающих более высокую остроту зрения по сравнению с другими группами позвоночных; голубей даже называют «крылатыми глазами»[1]. Птичий глаз напоминает глаз рептилии, он обладает развитой цилиарной мышцей, способной изменять форму хрусталика быстрее и сильнее, чем у млекопитающих. По внутреннему строению они схожи с глазами других позвоночных, но имеют уникальную структуру — гребень. В животном царстве у птиц самые большие глаза относительно размера тела. Движение глаз ограничено склеротическим кольцом[1]. В дополнение к двум векам, обычно имеющимся у позвоночных животных, глаза птиц защищены третьей прозрачной подвижной мембраной.
Некоторые группы птиц обладают особыми модификациями зрительной системы, связанными с их образом жизни. У хищных птиц большая плотность зрительных рецепторов в сетчатке повышает остроту зрения. Расположение глаз обеспечивает им хорошее бинокулярное зрение, позволяющее точно оценивать расстояние. У птиц, ведущих ночной образ жизни, трубчатые глаза с небольшим количеством цветовых зрительных рецепторов, но с многочисленными палочками, которые хорошо функционируют при слабом освещении. Крачки, чайки и альбатросы принадлежат к числу птиц, у которых в цветовых рецепторах имеются красные или жёлтые масляные вкрапления, улучшающие зрение вдаль, особенно в условиях тумана.
Экстраокулярная анатомия
Глаз птицы наиболее похож на глаз пресмыкающихся. В отличие от млекопитающих, форма глаза птиц не сферическая, а уплощённая, которая способна удерживать в фокусе большое поле зрения. Круг из костных пластин вокруг глаза, склеротическое кольцо, обеспечивает поддержку. Глаз птиц отличается от глаза рептилии способностью хрусталика выдвигаться вперёд, увеличивая размер изображения на сетчатке. Подобная особенность встречается и у млекопитающих[2].
Глаза у большинства видов малоподвижны, поэтому птицам приходится часто двигать головой, чтобы хорошо рассмотреть окружающую среду (исключением является большой баклан)[3].

У большинства птиц глаза располагаются по бокам головы. При этом поле зрения каждого глаза составляет 150-170°, но поле бинокулярного зрения обычно невелико и составляет у многих птиц лишь 20-30°. Птицы, у которых глаза находятся по бокам головы, имеют широкое поле зрения, что помогает им обнаруживать хищников. Пернатые, чьи глаза расположены фронтально, такие как совы, обладают бинокулярным зрением и способны хорошо оценивать расстояние при охоте[4]. У американского вальдшнепа, вероятно, самое большое поле зрения из всех птиц — 360° в горизонтальной плоскости и 180° в вертикальной[5]. У птиц, имеющих две области острого зрения они обычно располагаются так, что одна из них проецируется на область бинокулярного зрения, а другая - на область монокулярного зрения.

Птицы не используют веки, чтобы моргать. Вместо век глаз смазывается мигательной перепонкой, третьим скрытым веком, которое двигается горизонтально, как стеклоочиститель[6]. У многих водоплавающих птиц, когда они находятся под водой, мигательная мембрана покрывает глаза и действует подобно контактным линзам[7]. У большинства птиц во время сна нижнее веко поднимается, чтобы прикрыть глаза. Исключением является рогатая сова, у которой подвижно верхнее веко[8].
Выделения из слёзной железы очищают глаз, а маслообразное вещество, вырабатываемое гардеровой железой, выполняет защитную функцию, покрывая роговицу и предотвращая высыхание. Глаза птицы больше по сравнению с размером тела, чем у любой другой группы животных, хотя большая часть его скрыта внутри черепа. У страуса самые крупные глаза среди наземных позвоночных, их осевая длина равна 50 мм, что вдвое больше, чем у человеческого глаза[1].
Размер глаз птицы напрямую связана с массой тела. Изучение пяти отрядов (попугаи, голуби, буревестники, хищники и совы) показали, что масса глаз пропорциональна массе тела, но в силу образа жизни и экологии хищные птицы и совы имеют относительно более крупные глаза для их массы тела[9].
Поведенческие исследования показывают, что многие виды птиц фокусируются на удалённых предметах преимущественно с помощью латерального и монокулярного зрения и меняют свою ориентацию таким образом, чтобы повысить визуальное разрешение. У голубя боковое монокулярное зрение обеспечивает разрешение в два раза лучше, чем направленное вперёд бинокулярное зрение, в то время как у человека наоборот[1].

Эффективность зрения при низком уровне освещённости зависит от расстояния между хрусталиком и сетчаткой. Мелкие птицы обычно ведут дневной образ жизни, поскольку их глаза недостаточно велики, чтобы обеспечить адекватное ночное видение. Хотя многие виды мигрируют в ночное время, они часто сталкиваются с даже ярко освещёнными объектами, такими как маяки или нефтяные платформы. У дневных хищников большие глаза оптимизированы, чтобы обеспечивать максимальное пространственное разрешение, а не для улавливания света, поэтому они не очень хорошо функционируют при плохом освещении[10]. У многих птиц структура глаз асимметрична, что позволяет им держать горизонт и значительную часть земли в фокусе одновременно. Ценой этой адаптации является миопия в нижней части зрительного поля[1].
Птицы с большими глазами относительно массы тела, такие как общие горихвостки и зарянки, поют на рассвете, раньше птиц такого же размера с меньшей массой тела. Однако, если у птиц глаза имеют одинаковый размер, а масса тела отличается, более крупные виды поют позже меньших. Вероятно, это это объясняется тем, что мелкие птицы начинают день раньше из-за потери веса за ночь. Такая потеря у мелких птиц обычно составляет 5—10 %, а в холодные зимние ночи может достигать 15 % и более[11]. В одном исследовании было установлено, малиновки набирали массу за счёт кормления в сумерках, когда ночи были холодными[12].
Глаза ночных птиц обладают повышенной зрительной чувствительностью за счёт более крупной роговицы по отношению к длине глаза, а глаза дневных птиц обеспечивают более острое зрение благодаря большей длине глаз по отношению к диаметру роговицы. Посредством измерений склеротического кольца и глубины орбиты можно получить информацию об образе жизни вымерших видов. Для выполнения последнего измерения необходимы трёхмерные ископаемые, поэтому плоские ископаемые отпечатки образцов, подобных археоптериксу, не могут служить объектом для достоверных исследований глубины глазницы[13].
Анатомия глаза

Основные структуры глаза птицы сходны со структурами глаз других позвоночных. Наружный слой глаза впереди состоит из прозрачной роговицы и двух слоёв склеры — жёсткого слоя коллагеновых волокон белого цвета, который окружает остальную часть глаза, поддерживает и защищает глаз в целом. Внутри глаз разделён хрусталиком на два основных сегмента: передний и задний. Передний сегмент заполнен водянистой влагой, а в заднем содержится стекловидное тело, прозрачная желеобразная субстанция.
Хрусталик представляет собой прозрачное двояковыпуклое тело с жёстким наружным и мягким внутренним слоем. Он фокусирует свет на сетчатке. Форма хрусталика может быть изменена цилиарными мышцами, которые непосредственно прикреплены к нему посредством зонулярных волокон. Помимо этих мышц у некоторых птиц есть также дополнительные мышцы Крэмптона, которые могут менять форму роговицы, тем самым обеспечивая более широкий диапазон аккомодации, чем у млекопитающих. Такая аккомодация у ныряющих водоплавающих птиц, таких как в крохали, может быть очень быстрой. Радужная оболочка — это цветная мышечная диафрагма перед хрусталиком, которая регулирует количество света, попадающего в глаз. В центре радужки находится зрачок, изменяющееся круглое отверстие, через которое свет попадает в глаз[2][14].

Сетчатка — относительно гладкая изогнутая многослойная структура, содержащая фоточувствительные клетки палочки и конусы с соответствующими нейронами и кровеносными сосудами. Плотность фоторецепторов имеет важное значение в определении максимальной достижимой остроты зрения. У людей имеется около 200 000 рецепторов на мм2, у домового воробья их 400 000, а у обыкновенного канюка — 1,000,000. Не все фоторецепторы имеют индивидуальное соединение со зрительным нервом, разрешение в большой степени определяется соотношением нервных ганглиев к рецепторам. У птиц этот показатель очень высок; у белой трясогузки приходится от 100 000 ганглизоных клеток на 120 000 фоторецепторов[2].
Палочки более чувствительны к свету, но не дают информации о цвете, в то время как менее светочувствительные колбочки обеспечивают цветное зрение. У дневных птиц 80 % рецепторов могут составлять колбочки (до 90 % у некоторых стрижей), тогда у как ночных сов рецепторы представлены почти исключительно палочками. У птиц, как и у других позвоночных, за исключением плацентарных млекопитающих, колбочки бывают двойными. У некоторых видов подобные двойные колбочки могут составлять до 50 % всех рецепторов подобного типа[15].
К центру сетчатки расположена центральная ямка (или менее специализированная area centralis) с большой плотностью рецепторов. Это область наибольшей остроты переднего зрения, то есть резкого и чёткого обнаружения объектов. У 54 % птиц, включая хищных, зимородков, колибри и ласточек, есть вторая центральная ямка для улучшенного бокового обзора. Зрительный нерв представляет собой пучок нервных волокон, которые несут информацию от глаза в соответствующие участки мозга и наоборот. Подобно млекопитающим, на оптическом диске у птиц есть небольшое слепое пятно, лишённое фоторецепторов, это место присоединения зрительного нерва и сосудов к глазу[2].
Гребень является малоизученным органом, состоящим из складчатой ткани, который находится под сетчаткой. Он хорошо снабжён кровеносными сосудами и, вероятно, питает сетчатку[1], а также защищает её от ослепительного света или помогает обнаруживать движущиеся объекты[2]. Глазной гребень обильно наполнен гранулами меланина, которые поглощают рассеянный свет, попадающий в глаза птицы, уменьшая фоновые блики. Небольшое потепление гребня вследствие поглощения света гранулами меланина предположительно повышает интенсивность метаболизма гребня, увеличивая секрецию питательных веществ в стекловидное тело, которые в конечном счете будут поглощены аваскулярной сетчаткой, что улучшает её питание[16]. Вероятно, очень высокая ферментативная активность щелочной фосфатазы в глазном гребне поддерживает его высокую секреторную функцию для дополнительного питания сетчатки[17].
Хориоидеа — слой, расположенный позади сетчатки, который содержит множество мелких артерий и вен. Они обеспечивают в сетчатке приток артериальной и отток венозной крови. В сосудистой оболочке содержится меланин, пигмент, который придает внутреннему глазу тёмную окраску и помогает предотвратить разрушительные блики.
Восприятие света

В глазу птиц присутствует два типа световых рецепторов, палочки и колбочки. Палочки, которые содержат зрительный пигмент родопсин, приспособлены для ночного видения, потому что они чувствительны даже к небольшому количеству света. Конусы воспринимают определённые цвета (или длины волны) света, поэтому они более важны для животных, ориентирующихся по цвету, таких как птицы[20]. Большинство птиц обладают тетрахроматическим зрением, у них четыре типа колбочек, с характерным для каждого типа пиком максимального поглощения. У некоторых птиц пик максимального поглощения колбочек отвечает за самую короткую длину волны и распространяется на ультрафиолетовый (УФ) диапазон[21]. Кроме того, колбочки на сетчатке птиц имеют характерный порядок пространственного распределения, который максимально увеличивает поглощение света и цвета[22].
Четыре спектрально различимых пигмента колбочек являются производными белка опсина, ковалентно связанного с небольшой молекулой ретиналя, альдегидной формы витамина А. Когда пигмент поглощает свет, ретиналь меняет форму и мембранный потенциал колбочек, влияющий на нейроны в слое ганглиев сетчатки. Каждый нейрон в ганглиозном слое обрабатывает информацию от клеток фоторецепторов, и в свою очередь может испускать нервные импульсы для передачи информации по зрительному нерву для дальнейшей обработки в специализированных зрительных центрах головного мозга. Чем интенсивнее свет, тем больше фотонов поглощается зрительными пигментами, сильнее возбуждение каждой колбочки и ярче восприятие света[20].
У птиц самым распространённым пигментом в колбочках является йодопсин, который поглощает волны длиной около 570 нм. Это спектральная область, которую в сетчатке приматов занимают пигменты, чувствительные к красному и зелёному[23]. У пингвинов пик поглощения этого пигмента смещён к 543 нм, предположительно из-за адаптации к синей водной среде[24].
Информация, передаваемая одной колбочкой, ограничена: сама по себе клетка не может сообщить мозгу, какая длина волны света вызвала её возбуждение. Визуальный пигмент может поглотить в равной степени волны двух длин, но даже если их фотоны несут разную энергию, колбочка не может отличить их друг от друга, поскольку они обе меняют форму ретиналя и вызывают один и тот же импульс. Чтобы мозг увидел цвет, он должен сравнить реакцию двух или более классов колбочек, содержащих различные зрительные пигменты, поэтому присутствие у птиц четырёх пигментов увеличивают дифференциацию[20].
Каждая колбочка птицы или рептилии содержит каплю окрашенного масла, в организме млекопитающих подобное вещество отсутствует. Капли с высоким содержанием каротиноидов размещены таким образом, что свет, прежде чем достичь зрительного пигмента, проходит через них. Они выступают в качестве фильтров, удаляя волны некоторых длин и сужая спектр поглощения пигментов. Это уменьшает перекрытие реакций между пигментами и увеличивает количество цветов, различаемых птицами[20]. В колбочках выявлены шесть типов масляных капель; пять из них представляют собой смеси каротиноидов, которые поглощают волны различной длины и интенсивности, а в шестом типе пигменты отсутствуют[25]. Пигменты колбочек с низким пиком максимального поглощения, в том числе УФ-чувствительные, содержат «прозрачные» масляные капли с небольшим эффектом спектральной настройки[26].
Цвет и распределение масляных капель в сетчатке существенно различаются между видами и в большей степени зависят от занимаемой экологической ниши (хищная птица, насекомоядная, рыбоядная, растительноядная), чем от генетических отношений. Например, дневные охотники, такие как деревенская ласточка, и хищные птицы имеют несколько разноцветных капель, в то время как у крачек, охотящихся у поверхности воды, в дорсальной сетчатке сосредоточено большое количество красных и жёлтых капелек. Это говорит о том, что масляные капли видоизменяются в соответствии с естественным отбором быстрее, чем зрительные пигменты колбочек[23]. Даже в пределах видимого человеком диапазона длин волн воробьиные способны обнаружить цветовые различия, которых люди не воспринимают. Эта более точная дифференциация вкупе со способностью видеть в ультрафиолетовом диапазоне означает, что множество видов демонстрируют половой дихроматизм, различимый для птиц, но не людей[27].
Перелетные певчие птицы в ходе миграций ориентируются по магнитному полю Земли, звёздам, Солнцу и прочим неизвестным науке сигналам. Одно исследование показало, что саванные овсянки используют поляризованный свет, исходящий от участка неба у горизонта, для подстройки своей магнитной системы навигации на восход и закат. Это позволяет предположить, что поляризованный верхний свет является первичным ориентиром для всех перелетных певчих птиц[28]. Однако оказалось, что птицы могут реагировать на второстепенные признаки угла поляризации, и, вероятно, на самом деле не способны напрямую обнаружить направление поляризации при отсутствии этих сигналов[29].
Чувствительность к ультрафиолету

У птиц существует два типа цветового зрения: чувствительный к фиолетовому цвету и чувствительный к ультрафиолету[30]. В колбочках сетчатки птиц, чувствительных к ультрафиолету, имеется зрительный пигмент, который поглощает ультрафиолетовый свет, позволяя им видеть эту часть спектра. К кладам птиц с чувствительностью к ультрафиолету относятся бескилевые, ржанкообразные (кулики, чайки и чистиковые), трогоновые (трогоны), попугаеобразные и воробьиные (к которым принадлежат более половины всех видов птиц)[30].
Способность воспринимать ультрафиолет иногда играет роль во время ухаживания. Многие птицы в полной мере демонстрируют свой брачный наряд в ультрафиолетовом свете; у некоторых птиц самцы и самки на первый взгляд кажутся похожими, но они отличаются наличием на перьях участков, отражающих ультрафиолетовый свет. Во время ухаживания самец лазоревки демонстрируют такую светоотражающую «корону», приподнимая перья на затылке[31]. Самыми яркими и крупными отметинами в оперении, отражающими ультрафиолет, обладают самцы синей щуры[20].
В общении дроздов важную роль играет внешний вид клюва. Хотя УФ-компоненты кажутся неважными при взаимодействии между территориальными самцами, для которых основным фактором является оранжевый цвет, самки сильнее реагируют на самцов, у которых клювы хорошо отражают ультрафиолет[32].
Зрение в ультрафиолетовом диапазоне даёт птицам преимущество в поисках пищи. Восковая поверхность многих фруктов и ягод отражает ультрафиолетовое излучение, и птицам становится проще найти плоды[20][33][34].
Восприятие
Контрастная чувствительность
Контрастность определяется как разница в яркости между двумя раздражителями, разделенная на сумму их яркости. Контрастная чувствительность представляет собой обратное наименьшему контрасту, который можно обнаружить, например, контрастная чувствительность равная 100 означает, что наименьший контраст, который можно увидеть равен 1 %. У птиц сравнительно низкая контрастная чувствительность по сравнению с млекопитающими. Люди могут увидеть контрасты 0,5—1 %[35], в то время как большинству птиц для получения реакции необходимо 10 % контраста[36][37][38]. Функция контрастной чувствительности описывает способность животных обнаруживать контраст моделей различной пространственной частоты (детали)[39].
Движение

Птицы видят быстрые движения лучше людей, для которых мелькание со скоростью больше 50 Гц воспринимается как непрерывное движение. Поэтому человек не может различить отдельные вспышки люминесцентной лампы, колеблющейся с частотой 60 Гц, однако у волнистых попугайчиков и цыплят порог мерцания составляет более 100 Гц[40]. Куперов ястреб способен стремительно преследовать добычу сквозь лес, избегая ветвей и других препятствий на высокой скорости; для человека такая погоня будет выглядеть как в тумане[5].
Кроме того птицы способны обнаружить медленно движущиеся объекты. Движение солнца и звёзд по небу незаметны для человека, но очевидны для птиц. Эта способность позволяет перелётным птицам ориентироваться во время миграций[5].
Для получения стабильного изображения во время полета или сидя на покачивающейся ветке птицы удерживают голову в максимально стабильном положении, компенсируя колебания. Эта способность особенно важна для хищных птиц[5].
Магнитные поля
Считается, что восприятие магнитного поля перёлетными птицами зависит от света[41]. Птицы поворачивают голову, чтобы определить направление магнитного поля[42], на основании исследований нейронных путей было сделано предположение, что птицы способны «видеть» магнитное поле[43]. Правый глаз перелётной птицы содержит cветочувствительные белки криптохромы. Свет возбуждает эти молекулы, которые выпускают непарные электроны, взаимодействующие с магнитным полем Земли, обеспечивая информацию о направлении[44][43].
Различия между группами птиц
Дневные хищные птицы

Зрительные способности и в частности острота зрения хищных птиц слывут легендой по ряду факторов. У хищников крупные глаза относительно их собственного размера, в 1,4 раза больше, чем в среднем для птиц такого же веса[9]. Кроме того, глаза имеют форму трубы, благодаря которой на сетчатке получается большее изображение. Разрешающая способность глаза зависит как от оптики (крупные глаза с большой диафрагмой меньше страдают от дифракции, на сетчатке получается более крупное изображение из-за длинного фокусного расстояния), так и от повышенной концентрации рецепторов. Для сетчатки дневных хищных птиц характерна высокая плотность рецепторов на квадратный миллиметр, что и определяет степень остроты зрения. Чем больше рецепторов, тем выше способность животного различать отдельные объекты на расстоянии, особенно когда, как у хищников, каждый рецептор соединён с одним ганглием[1]. Вероятно, форма глубокой центральной ямки хищных птиц может создавать оптическую систему, подобную телеобъективу[45], которая увеличивает размер изображения на сетчатке в ямке и тем самым повышает пространственное разрешение. Исследования поведения показывают, что у некоторых крупных хищников (клинохвостый орёл, грифы Старого Света) пространственное разрешение в 2 раза выше, чем у людей, однако у средних и малых хищных птиц этот показатель сопоставим или ниже по сравнению с человеком[46][47][48][49][50][51].
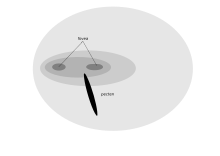
Фронтальное расположение глаз хищной птицы обеспечивают бинокулярное зрение, которому способствует двойная центральная ямка[2]. Приспособленность дневного хищника, позволяющая получить изображение высокого разрешения (воробьиная пустельга способна рассмотреть насекомое длиной 2 мм с верхушки 18-метрового дерева) имеет свой недостаток: у этих птиц слабое зрение в условиях низкой освещённости, поэтому в тёмное время они отправляются на ночлег[1] Хищники способны следить за подвижной добычей в нижней части своего зрительного поля, следовательно миопия в этом зрительном пространстве, характерная для множества других птиц, у них отсутствует[1]. Птицы-падальщики, например, стервятники, не нуждаются в таком остром зрении, поэтому у кондора имеется единственная центральная ямка с примерно 35000 рецепторов на мм2. Однако для них характерна высокая физиологическая активность многих важных ферментов, обеспечивающая ясное видение на дальние расстояния[53].
Как и у прочих пернатых, у дневных хищников в колбочках тоже имеются цветные масляные капли[48][49][54]. У этих птиц, как правило, коричневое, серое и белое оперение, а яркий брачный наряд не характерен, вероятно, цветовое восприятие не играет для них существенной роли[2].
У большинства хищников над глазом имеется заметный выступ, а перья образуют «бровь» над и перед глазом. Эти детали придают хищным птицам их характерный взгляд. Выступ физически защищает глаза от ветра, пыли и мусора, а также сильных бликов. У скопы нет этого выступа, хотя "брови" над глазами выполняют аналогичную функцию; тёмные перья у них, вероятно, уменьшают блики от поверхности воды, когда птица охотится на рыбу, составляющую основу её рациона[5].
Ночные птицы


У сов фронтально расположенные и очень крупные глаза относительно размеров тела, у них это соотношение в 2,2 раза больше, чем в среднем у птиц сопоставимой массы[9]. Поля зрения глаз имеют перекрытие 50—70 %, обеспечивая лучшее по сравнению с дневными хищными птицами бинокулярное зрение[55]. В сетчатке неясыти плотность рецепторов составляет около 56000 светочувствительных палочек на квадратный миллиметр. Прежние предположения, будто эта птица способна видеть в инфракрасном диапазоне, не получили подтверждений[56]. Глаза ночных птиц имеют следующие адаптации к их образу жизни: крупный размер, трубчатая форма,[2] большое количество и высокая концентрация палочек на сетчатке и отсутствие колбочек, имеющих низкую светочувствительность. Масляные капли, сокращающие интенсивность света, имеются в небольшом количестве, зато на сетчатке имеется светоотражающий слой — тапетум. Он повышает количество света, получаемого каждым светочувствительным рецептором, улучшая тем самым зрение в условиях низкой освещённости[2]. Обычно у сов имеется одна слаборазвитая центральная ямка, за исключением дневных охотников, типа болотной совы[55].
Помимо сов хорошим ночным зрением обладают лягушкороты, ястребы и козодои. Некоторые виды гнездятся глубоко в тёмных пещерах и находят дорогу к гнезду с помощью эхолокации. Из ночных птиц способностью к эхолокации обладает только гуахаро[57]. Некоторые виды рода Aerodramus также используют эту технику, а Aerodramus sawtelli ориентируется посредством эхолокации и вне пещер[58][59].
Водоплавающие птицы

У морских птиц, таких как крачки и чайки, которые питаются на поверхности или ныряют в воду, в колбочках сетчатки присутствуют красные масляные капли. Эта адаптация повышает контраст и остроту зрения на расстоянии, особенно при неясной погоде[2]. У птиц, которым приходится смотреть сквозь поверхность между водой и воздухом, в состав масляных капель входят более насыщенно окрашенные каротиноидные пигменты, по сравнению с другими видами[23]. Они помогают точнее определить местоположение косяка рыб или скопления планктона, которые составляют основу их рациона[60].
Птицы, высматривающие добычу над поверхностью воды, должны корректировать рефракцию, особенно при наблюдении под углом. Восточные рифовые цапли и малые белые цапли, вероятно способны осуществлять подобную поправку, поскольку они чаще достигают успеха при атаке под острым углом, тем более при таком нападении рыбам труднее заметить опасность[61]. Другие исследования показывают, что цапли атакуют под предпочтительным углом, и что вероятность промахов увеличивается, когда угол слишком сильно отклоняется от вертикали, что приводит к увеличению разницы между видимой и реальной глубиной, где находится добыча[62]. У птиц, охотящихся под водой, подобно чистиковым и гагарам, в колбочках имеется гораздо меньше масляных цветных капель[2], однако у них гибкий хрусталик, кроме того, в качестве дополнительного преломляющего элемента они используют мигательную мембрану. Вкупе это повышает оптическую аккомодацию, обеспечивающую хорошее зрение в воздухе и под водой[7]. У бакланов самый большой диапазон зрительной аккомодации среди птиц, который составляет 50 диоптрий, но считается, что наилучшим всесторонним зрением, охватывающим воздух и воду, обладают зимородки[2].
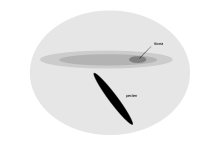
Буревестникообразные прилетают на берег только для размножения и большую часть жизни проводят, паря у поверхности океанов. У них на сетчатке имеется длинная и узкая область зрительной чувствительности[1]. Эта область, area giganto cellularis, также была обнаружена у малых буревестников, кергеленских тайфунников, больших пестробрюхих буревестников, ширококлювых китовых птичек и обыкновенных нырковых буревестников. Она характеризуется наличием более крупных, чем в остальной части сетчатки, и выстроенных по порядку ганглиозных клеток, морфологически похожих на клетки сетчатки кошек. Расположение и клеточная морфология этой новой области предполагает функцию обнаружения элементов в небольшом бинокулярном поле ниже и вокруг клюва. Она не связана с высоким пространственным разрешением, но, вероятно, помогает обнаружить добычу у поверхности моря, когда птица летит низко над водой[63].
Подобно другим морским птицам, малые буревестники посещают гнездовые колонии в ночное время, чтобы уменьшить вероятность атаки пернатых хищников. Два аспекта зрительной структуры дают основание предположить, что глаза этих птиц адаптированы к ночному видению. В глазах буревестника основное преломление света, необходимого для формирования изображения на сетчатке, происходит в хрусталике. Роговица, внешнее покрытие глаза, относительна плоская и не несет существенной преломляющей оптической функции. У дневных птиц, подобных пингвинам, глаз устроен наоборот: роговица сильно изогнута и является основной преломляющей структурой. Соотношение преломления света между хрусталиком и роговицей у буревестника составляет 1:6, а у пингвина 0:4. Этот показатель у буревестника сопоставим с целым рядом ночных птиц и млекопитающих[64].
Сравнительно короткое фокусное расстояние глаза буревестника обеспечивает небольшое, но более яркое изображение, чем у голубя, обладающего более острым дневным зрением. Хотя малые буревестники имеют адаптации для ночного видения, оказываемый ими эффект невелик, и вполне вероятно, что эти птицы определяют местонахождение гнёзд также по запаху и звукам[64].
Раньше считалось, что пингвины на суше дальнозорки. Однако, несмотря на то, что их плоская роговица приспособлена для плавания под водой, мощный хрусталик способен компенсировать слабый фокус роговицы при выходе из воды. У хохлатых крохалей имеется противоположный механизм компенсации: у них при погружении часть хрусталика выступает через радужку[55].
Примечания
- 1 2 3 4 5 6 7 8 9 10 Whittow G. Causey. Sensory physiology: vision // Sturkie's Avian Physiology / Güntürkün, Onur. — Academic Press, 1999. — P. 1—18. — 704 p.
- 1 2 3 4 5 6 7 8 9 10 11 12 Sinclair, Sandra. How Animals See: Other Visions of Our World. — Beckenham, Kent: Croom Helm, 1985. — ISBN 0-7099-3336-3.
- ↑ Craig R. White, Norman Day, Patrick J. Butler, Graham R. Martin. Vision and Foraging in Cormorants: More like Herons than Hawks? // PLOS ONE. — 2007-07-25. — Т. 2. — Vol. 7. — P. 639. — ISSN 1932-6203. — DOI:10.1371/journal.pone.0000639.
- ↑ Graham R. Martin, Gadi Katzir. Visual Fields in Short-Toed Eagles, Circaetus gallicus (Accipitridae), and the Function of Binocularity in Birds // Brain, Behavior and Evolution. — Т. 53. — Vol. 2. — P. 55—66. — DOI:10.1159/000006582.
- 1 2 3 4 5 Jones, Michael P; Pierce Jr, Kenneth E.; Ward, Daniel. Avian vision: a review of form and function with special consideration to birds of prey // Journal of Exotic Pet Medicine. — April 2007. — Vol. 16, № (2). — P. 69—87. Архивировано 17 декабря 2008 года.
- ↑ David L. Williams, Edmund Flach. Symblepharon with aberrant protrusion of the nictitating membrane in the snowy owl (Nyctea scandiaca) (англ.) // Veterinary Ophthalmology. — 2003-03-01. — Vol. 6, iss. 1. — P. 11–13. — ISSN 1463-5224. — DOI:10.1046/j.1463-5224.2003.00250.x.
- 1 2 Gill, Frank. Ornithology. — New York: WH Freeman and Co, 1995. — ISBN 0-7167-2415-4.
- ↑ William Beebe. The bird, its form and function. — New York, H. Holt and Co., 1906-01-01. — 528 с.
- 1 2 3 Brooke, M. de L.; Hanley, S.; Laughlin, S. B. (February 1999). Brooke, M. de L.; Hanley, S.; Laughlin, S. B. The scaling of eye size with body mass in birds // Proceedings of the Royal Society. — (February 1999). — Vol. 266, № (1417). — P. 405—412. — DOI:10.1098/rspb.1999.0652. — PMID 1689681.
- ↑ Harris Philip Zeigler, Hans-Joachim Bischof. Producing the image // Vision, Brain, and Behavior in Birds / Martin, Graham. — MIT Press, 1993. — P. 5—24. — ISBN 026224036X.
- ↑ Robert J. Thomas, Tamás Széskely, Innes C. Cuthill, David G. C. Harper, Stuart E. Newson. Eye size in birds and the timing of song at dawn (англ.) // Proceedings of the Royal Society of London B: Biological Sciences. — 2002-04-22. — Vol. 269, iss. 1493. — P. 831–837. — ISSN 0962-8452. — DOI:10.1098/rspb.2001.1941.
- ↑ Robert J. Thomas, Innes C. Cuthill. Body mass regulation and the daily singing routines of European robins // Animal Behaviour. — 2002-02-01. — Т. 63. — Vol. 2. — P. 285–295. — DOI:10.1006/anbe.2001.1926.
- ↑ Margaret I. Hall. The anatomical relationships between the avian eye, orbit and sclerotic ring: implications for inferring activity patterns in extinct birds (англ.) // Journal of Anatomy. — 2008-06-01. — Vol. 212, iss. 6. — P. 781–794. — ISSN 1469-7580. — DOI:10.1111/j.1469-7580.2008.00897.x.
- ↑ Jacob G. Sivak. Through the Lens Clearly: Phylogeny and Development // Investigative Opthalmology & Visual Science. — 2004-03-01. — Т. 45. — Vol. 3. — ISSN 1552-5783. — DOI:10.1167/iovs.03-0466.
- ↑ Harris Philip Zeigler, Hans-Joachim Bischof. Exploring the Image // Vision, Brain, and Behavior in Birds / Nalbach Hans-Ortwin; Wolf-Oberhollenzer, Friedericke; Remy Monika. — MIT Press, 1993. — P. 25—46. — 448 p. — ISBN 026224036X.
- ↑ S.R. Bawa, Rakesh C. YashRoy. Structure and function of vulture pecten // Cells Tissues Organs. — Т. 89. — Vol. 3. — P. 473—480. — DOI:10.1159/000144308.
- ↑ S. R. Bawa, Rakesh C. YashRoy. Effect of dark and light adaptation on the retina and pecten of chicken // Experimental Eye Research. — 1972-01-01. — Т. 13. — Vol. 1. — P. 92—97. — DOI:10.1016/0014-4835(72)90129-7.
- ↑ Hart, NS; Partridge, J.C.; Bennett, A.T.D.; Cuthill, I.C. (2000).
- ↑ The effect of the coloured oil droplets is to narrow and shift the absorption peak for each pigment.
- 1 2 3 4 5 6 Timothy H. Goldsmith. What Birds See // Scientific American. — 2006. — Vol. 295. — P. 68—75. — DOI:10.1038/scientificamerican0706-68.
- ↑ S E Wilkie, P M Vissers, D Das, W J Degrip, J K Bowmaker. The molecular basis for UV vision in birds: spectral characteristics, cDNA sequence and retinal localization of the UV-sensitive visual pigment of the budgerigar (Melopsittacus undulatus). // Biochemical Journal. — 1998-02-15. — Т. 330. — Vol. Pt 1. — P. 541–547. — ISSN 0264-6021.
- ↑ A Bird’s-Eye View of Nature’s Hidden Order | Quanta Magazine. www.quantamagazine.org. Проверено 8 октября 2016.
- 1 2 3 Harris Philip Zeigler, Hans-Joachim Bischof. Color vision of birds // Vision, Brain, and Behavior in Birds / Varela, F. J.; Palacios, A. G.; Goldsmith T. M.. — MIT Press, 1993. — P. 77—94. — 448 p. — ISBN 026224036X.
- ↑ J. K. Bowmaker, G. R. Martin. Visual pigments and oil droplets in the penguin, Spheniscus humboldti (англ.) // Journal of Comparative Physiology A. — 1985. — Vol. 156. — Vol. 1. — P. 71—77. — ISSN 0340-7594. — DOI:10.1007/BF00610668.
- ↑ Timothy H. Goldsmith, James S. Collins, Sherry Licht. The cone oil droplets of avian retinas // Vision Research. — 1984-01-01. — Т. 24. — Vol. 11. — P. 1661—1671. — DOI:10.1016/0042-6989(84)90324-9.
- ↑ M. Vorobyev, D. Osorio, A. T. D. Bennett, N. J. Marshall, I. C. Cuthill. Tetrachromacy, oil droplets and bird plumage colours (англ.) // Journal of Comparative Physiology A. — Vol. 183. — Vol. 11. — P. 621—633. — ISSN 0340-7594. — DOI:10.1007/s003590050286.
- ↑ Muir D. Eaton. Human vision fails to distinguish widespread sexual dichromatism among sexually «monochromatic» birds (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2005-08-02. — Vol. 102. — Vol. 31. — P. 10942—10946. — ISSN 0027-8424. — DOI:10.1073/pnas.0501891102.
- ↑ Rachel Muheim, John B. Phillips, Susanne Åkesson. Polarized Light Cues Underlie Compass Calibration in Migratory Songbirds (англ.) // Science. — 2006-08-11. — Vol. 313. — Vol. 5788. — P. 837—839. — ISSN 0036-8075. — DOI:10.1126/science.1129709.
- ↑ Verity J. Greenwood, Emma L. Smith, Stuart C. Church, Julian C. Partridge. Behavioural investigation of polarisation sensitivity in the Japanese quail (Coturnix coturnix japonica) and the European starling (Sturnus vulgaris) (англ.) // Journal of Experimental Biology. — 2003-09-15. — Vol. 206. — Vol. 18. — P. 3201—3210. — ISSN 0022-0949. — DOI:10.1242/jeb.00537.
- 1 2 Odeen, Anders; Hastad, Olle. The phylogenetic distribution of ultraviolet sensitivity in birds // BMC Evolutionary Biology. — 11 February 2013. — Vol. 13, № (36). — DOI:10.1186/1471-2148-13-36.
- ↑ Staffan Andersson, Jonas Örnborg, Malte Andersson. Ultraviolet sexual dimorphism and assortative mating in blue tits (англ.) // Proceedings of the Royal Society of London B: Biological Sciences. — 1998-03-22. — Vol. 265. — Vol. 1395. — P. 445—450. — ISSN 0962-8452. — DOI:10.1098/rspb.1998.0315.
- ↑ Ashleigh Bright, Joseph R. Waas. Effects of bill pigmentation and UV reflectance during territory establishment in blackbirds // Animal Behaviour. — 2002-08-01. — Т. 64. — Vol. 2. — P. 207—213. — DOI:10.1006/anbe.2002.3042.
- ↑ Jussi Viitala, Erkki Korplmäki, Pälvl Palokangas, Minna Koivula. Attraction of kestrels to vole scent marks visible in ultraviolet light (англ.) // Nature. — 1995-02-02. — Vol. 373, iss. 6513. — P. 425–427. — DOI:10.1038/373425a0.
- ↑ Olle Lind, Mindaugas Mitkus, Peter Olsson, Almut Kelber. Ultraviolet sensitivity and colour vision in raptor foraging (англ.) // Journal of Experimental Biology. — 2013-05-15. — Vol. 216. — Vol. 10. — P. 1819—1826. — ISSN 0022-0949. — DOI:10.1242/jeb.082834.
- ↑ Olle Håstad, Jonas Victorsson, Anders Ödeen. Differences in color vision make passerines less conspicuous in the eyes of their predators (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2005-05-03. — Vol. 102. — Vol. 18. — P. 6391—6394. — ISSN 0027-8424. — DOI:10.1073/pnas.0409228102.
- ↑ W. M. Harmening, P. Nikolay, J. Orlowski, H. Wagner. Spatial contrast sensitivity and grating acuity of barn owls // Journal of Vision. — 2009-07-01. — Т. 9. — Vol. 7. — P. 13. — ISSN 1534-7362. — DOI:10.1167/9.7.13.
- ↑ John R. Jarvis, Siobhan M. Abeyesinghe, Claire E. McMahon, Christopher M. Wathes. Measuring and modelling the spatial contrast sensitivity of the chicken (Gallus g. domesticus) // Vision Research. — 2009-06-01. — Т. 49. — Vol. 11. — P. 1448—1454. — DOI:10.1016/j.visres.2009.02.019.
- ↑ Mimi M. Ghim, William Hodos. Spatial contrast sensitivity of birds (англ.) // Journal of Comparative Physiology A. — 2006-01-11. — Vol. 192. — Vol. 5. — P. 523—534. — ISSN 0340-7594. — DOI:10.1007/s00359-005-0090-5.
- ↑ Daniel J. Uhlrich, Edward A. Essock, Stephen Lehmkuhle. Cross-species correspondence of spatial contrast sensitivity functions // Behavioural Brain Research. — 1981-05-01. — Т. 2. — Vol. 3. — P. 291—299. — DOI:10.1016/0166-4328(81)90013-9.
- ↑ Norman Ginsburg, Virginia Nilsson. Measuring flicker thresholds in the budgerigar // Journal of the Experimental Analysis of Behavior. — 1971-03-01. — Т. 15. — Vol. 2. — P. 189—192. — ISSN 0022-5002. — DOI:10.1901/jeab.1971.15-189.
- ↑ Henrik Mouritsen, Gesa Feenders, Miriam Liedvogel, Kazuhiro Wada, Erich D. Jarvis. Night-vision brain area in migratory songbirds (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2005-06-07. — Vol. 102. — Vol. 23. — P. 8339—8344. — ISSN 0027-8424. — DOI:10.1073/pnas.0409575102.
- ↑ Henrik Mouritsen, Gesa Feenders, Miriam Liedvogel, Wiebke Kropp. Migratory Birds Use Head Scans to Detect the Direction of the Earth's Magnetic Field // Current Biology. — Т. 14. — Vol. 21. — P. 1946—1949. — DOI:10.1016/j.cub.2004.10.025.
- 1 2 Dominik Heyers, Martina Manns, Harald Luksch, Onur Güntürkün, Henrik Mouritsen. A Visual Pathway Links Brain Structures Active during Magnetic Compass Orientation in Migratory Birds // PLOS ONE. — 2007-09-26. — Т. 2. — Vol. 9. — P. e937. — ISSN 1932-6203. — DOI:10.1371/journal.pone.0000937.
- ↑ Shanor, Karen; Kanwal, Jagmeet. Bats sing, mice giggle: revealing the secret lives of animals. — Icon Books, 2009. — P. 25. — ISBN 1-84831-071-4.
- ↑ Allan W. Snyder, William H. Miller. Telephoto lens system of falconiform eyes (англ.) // Nature. — 1978-09-14. — Vol. 275, iss. 5676. — P. 127–129. — DOI:10.1038/275127a0.
- ↑ Simon Potier, Francesco Bonadonna, Almut Kelber, Olivier Duriez. Visual acuity in an opportunistic raptor, the chimango caracara (Milvago chimango) // Physiology & Behavior. — Т. 157. — P. 125—128. — DOI:10.1016/j.physbeh.2016.01.032.
- ↑ Matthew F. Gaffney, William Hodos. The visual acuity and refractive state of the American kestrel (Falco sparverius) // Vision Research. — 2003-09-01. — Т. 43. — Vol. 19. — P. 2053—2059. — DOI:10.1016/S0042-6989(03)00304-3.
- 1 2 Reymond, Liz. Spatial visual acuity of the eagle Aquila audax: a behavioural, optical and anatomical investigation // Vision Research. — 1985. — Vol. 25, № (10). — P. 1477—1491. — DOI:10.1016/0042-6989(85)90226-3.
- 1 2 Reymond, Liz. Spatial visual acuity of the falcon, Falco berigora: A behavioural, optical and anatomical investigation // Vision Research. — 1987. — Vol. 27, № (10). — P. 1859—1874. — DOI:10.1016/0042-6989(87)90114-3.
- ↑ Fischer, Anna Barbara. Laboruntersuchungen und freilandbeobachtungen zum sehvermögen under verhalten von altweltgeiern // Zoologische Jahrbüche abteilung fur systematik (in German). — 1969. — № (96). — P. 81—132.
- ↑ Martin, Graham (1986).
- ↑ Schematic diagram of retina of right eye, loosely based on Sturkie (1998) 6
- ↑ S R Bawa, R C YashRoy. Vulture retina enzyme distribution and function // ResearchGate. — 1970-01-01. — Vol. 4, № 2. — ISSN 0300-8819.
- ↑ Mathew W. Wright, James K. Bowmaker. Retinal photoreceptors of paleognathous birds: the ostrich (Struthio camelus) and rhea (Rhea americana) // Vision Research. — 2001-01-01. — Т. 41. — Vol. 1. — P. 1—12. — DOI:10.1016/S0042-6989(00)00227-3.
- 1 2 3 Burton, Robert. Bird Behaviour. — London: Granada Publishing, 1985. — ISBN 0-246-12440-7.
- ↑ Selig Hecht, Maurice Henri Pirenne. The Sensibility of the Nocturnal Long-Eared Owl in the Spectrum (англ.) // The Journal of General Physiology. — 1940-07-20. — Vol. 6, no. 23. — P. 709—717. — ISSN 0022-1295. — DOI:10.1085/jgp.23.6.709.
- ↑ Cleere, Nigel; Nurney, David. Nightjars: A Guide to the Nightjars, Frogmouths, Potoos, Oilbird and Owlet-nightjars of the World. — Pica / Christopher Helm, 1998. — P. 7. — ISBN ISBN 1-873403-48-8.
- ↑ James H. Fullard, Robert M. R. Barclay, Donald W. Thomas. Echolocation in Free-Flying Atiu Swiftlets (Aerodramus sawtelli) // Biotropica. — 1993-01-01. — Т. 25. — Vol. 3, № 25. — P. 334—339. — DOI:10.2307/2388791.
- ↑ M. Konishi, E. I. Knudsen. The oilbird: hearing and echolocation (англ.) // Science. — 1979-04-27. — Vol. 4391, no. 204. — P. 425—427. — ISSN 0036-8075. — DOI:10.1126/science.441731.
- ↑ Lythgoe, J. N. The Ecology of Vision. — Oxford: Clarendon Press, 1979. — P. 180—183. — ISBN 0-19-854529-0.
- ↑ Arnon Lotem, Edna Schechtman, Gadi Katzir. Capture of submerged prey by little egrets, Egretta garzetta garzetta: strike depth, strike angle and the problem of light refraction // Animal Behaviour. — 1991-09-01. — Vol. 3, № 42. — P. 341—346. — DOI:10.1016/S0003-3472(05)80033-8.
- ↑ Gadi Katzir, Arnon Lotem, Nathan Intrator. Stationary underwater prey missed by reef herons,Egretta gularis: head position and light refraction at the moment of strike (англ.) // Journal of Comparative Physiology A. — Vol. 4, no. 165. — P. 573—576. — ISSN 0340-7594. — DOI:10.1007/BF00611243.
- ↑ Brian Hayes, Graham R. Martin, Michael de L. Brooke. Novel Area Serving Binocular Vision in the Retinae of Procellariiform Seabirds // Brain, Behavior and Evolution. — Vol. 2, № 37. — P. 79—84. — DOI:10.1159/000114348.
- 1 2 Graham R. Martin, M. de L. Brooke. The Eye of a Procellariiform Seabird, the Manx Shearwater, Puffinus puffinus: Visual Fields and Optical Structure // Brain, Behavior and Evolution. — Vol. 2, № 37. — P. 65—78. — DOI:10.1159/000114347.
См. также
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .