Поверхность потенциальной энергии применяется для описания энергии системы, в особенности множества атомов, в терминах определённых параметров, обычно — координат атомов. Поверхность может определять энергию как функцию одной или нескольких координат. Если координата только одна, то поверхность называется кривой потенциальной энергии или профилем энергии.
В некоторых случаях полезно использовать аналогию с ландшафтом: если у системы две степени свободы, то значение энергии можно представить как высоту в зависимости от двух координат.[1]
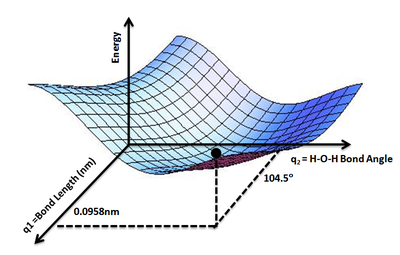
Понятие поверхности потенциальной энергии применяется в физике и химии, особенно в теоретических разделах этих дисциплин, и может использоваться для теоретического исследования свойств структур атомов, например, для определения формы с минимальной энергией для молекулы или для вычисления скорости химических реакций.
Математическое определение и вычисления
Геометрия набора атомов может быть описана вектором r, элементы которого показывают расположение атомов. Вектор r может быть множеством декартовых координат атомов или же набором межатомных расстояний и углов.
При известном r энергия является функцией E(r) для всех рассматриваемых значений r. Пользуясь аналогией с ландшафтом, можно рассматривать величину E как высоту "ландшафта энергии", то есть как меру высоты поверхности потенциальной энергии.
Для изучения химических реакций с помощью поверхности потенциальной энергии как функции положения атомов необходимо вычислять энергию для каждого рассматриваемого взаимного расположения частиц. Методы расчёта энергии для конкретного относительного расположения частиц описаны в статьях по вычислительной химии, особое внимание уделяется нахождению приближённого значения энергии E(r) для получения информации о энергии и положении частиц с высоким разрешением.
Для очень простых химических систем или при введении упрощающих предположений о взаимодействии атомов иногда возможно использовать аналитические выражения для энергии в виде функции расположения атомов. Примером является потенциал Лондона-Эйринга-Полани-Сато[2][3][4] для системы H + H2 в виде функции трёх расстояний H-H.
Для более сложных систем вычисление энергии определённого расположения атомов зачастую представляет собой слишком сложную вычислительную задачу, поэтому получить точки поверхности с высоким разрешением сложно. Для таких систем возможным подходом является вычисление только уменьшенного количества точек на поверхности и затем применение метода интерполяции, например интерполяции Шепарда.[5]
Применение
Поверхность потенциальной энергии является удобным инструментом для исследования молекулярной геометрии и динамики химических реакций. На поверхности вычисляются только необходимые точки. В целом точки классифицируют по значениям первой и второй производной энергии по координатам, то есть по величине градиента и кривизны. Стационарные точки (с нулевым градиентом) имеют физический смысл: минимум энергии соответствует физически устойчивым образцам, а седловые точки соответствуют переходным состояниям, точка с наибольшей высотой является координатой реакции.
Поверхности притяжения и отталкивания
Поверхности потенциальной энергии для химических реакций можно классифицировать как поверхности притяжения и отталкивания по сравнению величины длины химических связей.[6][7] Для реакции типа A + B—C → A—B + C, увеличение длины химической связи A—B определяется как R*AB = RAB − R0AB, где RAB является длиной химической связи A—B в переходном состоянии, а R0AB в молекуле продукта реакции. Аналогично для связи, разрушающейся при реакции, R*BC = RBC − R0BC, где R0BC относится к молекуле реагента.[8]
Для экзотермических реакций поверхность потенциальной энергии при R*AB > R*BC такова, что переходное состояние достигается при приближении реактантов друг к другу. После переходного состояния длина химической связи A—B продолжает уменьшаться, при этом большая часть выделяющейся энергии преобразуется в энергию колебаний.[8][9] Примером является гарпунный механизм K + Br2 → K—Br + Br.[8] Молекулы продукта реакции, переведённые под воздействием колебаний в возбуждённое состояние, могут быть обнаружены по инфракрасной хемолюминесценции.[10][11]
Поверхность потенциальной энергии для реакции H + Cl2 → HCl + Cl такова, что R*HCl < R*ClCl и состояние перехода достигается, когда продукты реакции разделяются.[8][9] Для реакции, в которой атом A (в данном случае H) легче, чем B и C, энергия реакции выделяется в основном в виде кинетической энергии продуктов реакции.[8] Для реакции типа F + H2 → HF + H, где атом A тяжелее чем B и C, происходит смешанное выделение энергии, как колебательной, так и энергии перемещения.[8]
В эндотермических реакциях тип поверхности определяет тип энергии, который наиболее эффективен в ходе реакции.[12]
История
Понятие поверхности потенциальной энергии для химических реакций впервые было предложено французским физиком Рене Марселеном в 1913 году.[13] Первое полуэмпирическое вычисление поверхности потенциальной энергии было представлено для реакци H + H2 Генри Эйрингом и Майклом Полани в 1931 году. Эйринг использовал поверхности потенциальной энергии для вычисления постоянных скорости реакции в теории переходных состояний в 1935 году.
Примечания
- ↑ Potential-energy (reaction) surface in Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997)
- ↑ Sato, S. (1955). “A New Method of Drawing the Potential Energy Surface”. Bulletin of the Chemical Society of Japan. 28 (7): 450. DOI:10.1246/bcsj.28.450.“On a New Method of Drawing the Potential Energy Surface”. The Journal of Chemical Physics. 23 (3): 592. 1955. Bibcode:1955JChPh..23..592S. DOI:10.1063/1.1742043.
- ↑ Keith J. Laidler, Chemical Kinetics (3rd ed., Harper & Row 1987) p.68-70 ISBN 0-06-043862-2
- ↑ Steinfeld J.I., Francisco J.S. and Hase W.L. Chemical Kinetics and Dynamics (2nd ed., Prentice-Hall 1998) p.201-2 ISBN 0-13-737123-3
- ↑ Moving least-squares enhanced Shepard interpolation for the fast marching and string methods, Burger SK1, Liu Y, Sarkar U, Ayers PW, J Chem Phys. 2009 130(2) 024103. doi: 10.1063/1.2996579.
- ↑ Attractive potential-energy surface in Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997)
- ↑ Repulsive potential-energy surface in Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997)
- 1 2 3 4 5 6 Keith J. Laidler, Chemical Kinetics (3rd ed., Harper & Row 1987) p.461-8 ISBN 0-06-043862-2
- 1 2 Steinfeld J.I., Francisco J.S. and Hase W.L. Chemical Kinetics and Dynamics (2nd ed., Prentice-Hall 1998) p.272-4 ISBN 0-13-737123-3
- ↑ Steinfeld J.I., Francisco J.S. and Hase W.L. Chemical Kinetics and Dynamics (2nd ed., Prentice-Hall 1998) p.263 ISBN 0-13-737123-3
- ↑ Atkins P. and de Paula J. Physical Chemistry (8th ed., W.H.Freeman 2006) p.886 ISBN 0-7167-8759-8
- ↑ Atkins P. and de Paula J. Physical Chemistry (8th ed., W.H.Freeman 2006) p.889-890 ISBN 0-7167-8759-8
- ↑ Computational Chemistry: Introduction to the Theory and Applications of Molecular and Quantum Mechanics Errol G. Lewars, 2nd ed. (Springer 2011) p.21 ISBN 978-9048138616
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .