Нанопоровое секвенирование — семейство высокоэффективных методов определения последовательности молекул ДНК или РНК с использованием белковых или твердотельных пор диаметром в несколько нанометров.
История
Первая работа, описывающая возможность применения нанопор для определения характеристик нуклеиновых кислот, появилась в 1996 году[1].
В 1999—2000 годах была показана возможность отличать одноцепочечную РНК от одноцепочечной ДНК, используя альфа-гемолизин стафилококка[2][3].
В 2001 году впервые была проведена работа по распознаванию наличия или отсутствия коротких последовательностей ДНК с помощью нанопор.[4] Только к 2009 году удалось показать возможность различать все основания в последовательности ДНК при использовании нанопор, необходимую для создания методов секвенирования[5].
В настоящий момент продемонстрировано принципиальное доказательство возможности применения данного метода — был секвенирован геном бактериофага phiX длиной 5,4 килобазы[6].
Принцип работы
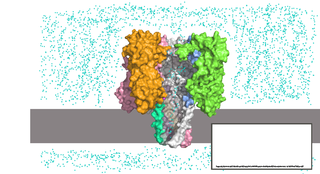
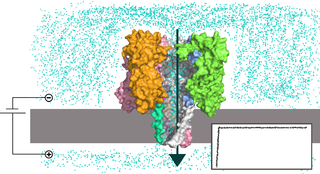
Нанопоровые системы представляют собой реакционную камеру, внутри которой находится раствор электролита. Камера разделена на две части липидной мембраной или иной тонкой непроводящей поверхностью, в которую внедрена единичная нанопора. К частям камеры прикладывают напряжение, из-за чего возникает ток ионов через пору. Когда исследуемые молекулы проходят через пору по направлению поля, они уменьшают сечение, доступное для ионов, и сила тока падает. Анализируя изменение силы тока, можно определить свойства молекулы, проходящей через пору.
В случае нуклеиновых кислот, диаметр используемых нанопор составляет несколько нанометров, из-за чего ДНК и РНК способны проходить сквозь пору только в одноцепочечной форме, но не в двухцепочечной. При прохождении молекулы нуклеиновой кислоты через пору отдельные нуклеотиды задерживаются в определенных сайтах внутри поры, в результате чего происходит измеримое падение силы тока.
Достоинства нанопорового секвенирования
По сравнению с уже существующими методами секвенирования применение нанопор обладает следующими преимуществами[7]:
- Дешевизна и простота использования, достигается отсутствием необходимости приготовления образца и использования реактивов;
- Высокая чувствительность, вплоть до секвенирования без амплификации ДНК из крови или слюны;
- Высокая длина прочтений, вплоть до десятков тысяч оснований.
Варианты нанопорового секвенирования
В зависимости от того, сохраняют ли секвенируемые молекулы нуклеиновых кислот свою химическую целостность, выделяют следующие методы[8]
Секвенирование целых цепочек
В данном методе цепи нуклеиновых кислот не расщепляются. Перенос целых молекул ДНК и РНК через пору может осуществляться следующими способами:
Транспорт под действием напряжения
Так как ДНК и РНК несут на себе отрицательный заряд, то самым простым способом транспорта молекулы нуклеиновой кислоты через пору является их электрофоретический перенос вместе с ионами. Проблемой данного метода является то, что для измерения падения тока ионов через пору изначально требуется большой ток, чтобы получить хорошее соотношение сигнал/шум. Но при увеличении приложенного напряжения увеличивается и скорость, с которой молекула нуклеиновой кислоты преодолевает пору, а значит уменьшается время распознавания каждого отдельного основания, из-за чего качество распознавания падает.
Транспорт под действием напряжения с расплетанием дуплексов
Уменьшить скорость прохождения одноцепочечной ДНК через пору можно, образуя с ней двухцепочечные участки с помощью комплементарных фрагментов ДНК. Тогда в ходе транспорта будет происходить расплетание данного участка, что и позволит дольше задерживать отдельные нуклеотиды в поре. Тем не менее, поскольку расплетение происходит не понуклеотидно, то время задержки нуклеотида в поре не является постоянным для всей последовательности.
Транспорт с использованием ферментов
Для того, чтобы каждый нуклеотид задерживался в поре на фиксированное время, можно использовать различные ферменты, которые будут пропускать нуклеотиды через пору по одному. Примером такого фермента является ДНК-полимераза. За счет приложенного напряжения комплекс ДНК-фермент изначально притянут к поре. Но теперь, прежде, чем очередной нуклеотид молекулы ДНК пройдет через пору, должен произойти один шаг синтеза второй цепи ДНК. Возникающая задержка оснований внутри поры позволяет более точно различать их.
Экзонуклеазное секвенирование
В данном методе цепь нуклеиновой кислоты нарезается на единичные нуклеотиды экзонуклеазой, расположенной в непосредственной близости от поры. Под действием поля отрицательно заряженные нуклеотиды самостоятельно попадают в пору, где происходит определение оснований.
Типы нанопор

Для секвенирования используют белковые нанопоры и синтетические твердотельные нанопоры[8].
Белковые нанопоры
Альфа-гемолизин
Альфа-гемолизин Staphylococcus aureus — нанопора, гептамерный белок, состоящий из двух доменов: ствола и головки поры. Головка поры содержит полость диаметром около 4,5 нм. В месте соединения ствола и головки находится сужение канала шириной 1,4 нм. Ствол поры состоит из 14 антипараллельных бета-тяжей, формирующих сквозной канал шириной около 2 нм. Внутри ствола находится три сайта распознавания, на которых задерживаются проходящие молекулы. Время пребывания разных нуклеотидов на этих сайтах разнится, что и позволяет отличать одни основания от других.
MspA
Порин A Mycobacterium smegmatis — нанопора, диаметром 1,2 нм. Обладает структурными особенностями, которые улучшают соотношение сигнал/шум при секвенировании ДНК по сравнению с альфа-гемолизином.
Моторный белок упаковки ДНК бактериофага phi29
В отличие от других пор данный белок в своей исходной форме не встраивается в мембрану, поэтому для его внедрения были использованы методы белковой инженерии. Ключевым отличием от вышеупомянутых белков является то, что имея больший диаметр канала, он способен пропускать двухцепочечную ДНК.
Твердотельные нанопоры
Помимо белковых нанопор также используются твердотельные нанопоры небиологической природы. Для анализа нуклеиновых кислот используют нанопоры в подложках из нитрида кремния и в монослоях графена. Их преимущества по сравнению с белковыми нанопорами: большая стабильность, разнообразие форм и размеров пор, сравнительная простота в использовании. Недостатками является то, что твердотельные нанопоры не обладают атомарной точностью в своей форме и возможностями регуляции, присущими белкам.
Коммерческое применение
Oxford Nanopore Techonologies
В феврале 2012 года на конференции AGBT во Флориде компания Oxford Nanopore Technologies представила прототипы двух платформ для высокопроизводительного секвенирования длинных фрагментов, основанные на нанопоровой технологии секвенирования целых цепочек: GridION и MinION. В качестве демонстрации был секвенирован геном бактериофага Phi X длиной 5386 оснований[6]. GridION — устройство, спроектированное для полногеномного секвенирования. Прототип имел 2000 отдельных нанопор, каждая из которых способна получать риды длиной до 5100 килобаз со скоростью 150 мегабаз/ч в течение 6 часов. MinION — одноразовый секвенатор небольшого размера, спроектированный для использования в домашних условиях, с запланированной ценой около 900$. Содержит 512 нанопор со сходными характеристиками[7].
По состоянию на начало 2017 года в продаже появились миниатюрные нанопоровые секвенаторы MinION, а в мае – GridION X5, разработанные компанией Oxford Nanopore Technologies (ONT, UK). Значительно более производительная модель PrometION X24, несущая 24 ячейки по 3000 нанопор, стала доступна доступна в 2018 году в режиме тестирования. В 2019 году запланирован официальный запуск продаж инструментов PrometION X24 (24 ячейки)и PrometION X48 (48 ячеек). Кроме того, ведётся разработка "карманного" секвенатора SmidgION для смартфона. [9][10][11]
См. также
Ссылки
- ↑ Kasianowicz, JJ; Brandin E, Branton D, Deamer DW (1996-11-26). “Characterization of individual polynucleotide molecules using a membrane channel”. Proc Natl Acad Sci USA. 93 (24): 13770—3. DOI:10.1073/pnas.93.24.13770. PMC 19421. PMID 8943010. Используется устаревший параметр
|coauthors=(справка) - ↑ Akeson, M.; Branton, D., Kasianowicz, J. J., Brandin, E., and Deamer, D. W. (1999). “Microsecond time-scale discrimination among polycytidylic acid, polyadenylic acid and polyuridylic acid as homopolymers or as segments within single RNA molecules”. Biophys J. 77: 3227—3233. PMID 10585944. Используется устаревший параметр
|coauthors=(справка) - ↑ Meller, A.; Nivon, L., Brandin, E., Golovchenko, J., and Branton, D. (2000). “Rapid nanopore discrimination between single polynucleotide molecules”. Proc Natl Acad Sci USA. 97: 1079—1084. PMC 15527. Используется устаревший параметр
|coauthors=(справка) - ↑ Howorka, S.; Cheley, S., Bayley, H. (2001). “Sequence-specific detection of individual DNA strands using engineered nanopores”. Nat Biotechnol. 19: 636—639. DOI:10.1038/90236. Используется устаревший параметр
|coauthors=(справка) - ↑ Stoddart, D.; Heron, A., Mikhailova, E., Maglia, G., and Bayley, H. (2009). “Single nucleotide discrimination in immobilized DNA oligonucleotides with a biological nanopore”. Proc Natl Acad Sci USA. 106: 7702—7707. DOI:10.1073/pnas.0901054106. Используется устаревший параметр
|coauthors=(справка) - 1 2 Eisenstein, Michael (2012). “Oxford Nanopore announcement sets sequencing sector abuzz”. Nat Biotechnol. 30 (04): 295–296. DOI:10.1038/nbt0412-295.
- 1 2 Maitra, RD; Kim J, Dunbar WB (2012). “Recent advances in nanopore sequencing”. Elps. 33 (23): 3418–3428. DOI:10.1002/elps.201200272. PMID 23138639. Используется устаревший параметр
|coauthors=(справка) - 1 2 Wanunu, Meni (2012). “Nanopores: A journey towards DNA sequencing”. Phys Life Rev. 9 (2): 125–158. DOI:10.1016/j.plrev.2012.05.010.
- ↑ Юрий Мильнер профинансирует электронное секвенирование ДНК, Lenta.ru (15 ноября 2013). Проверено 15 ноября 2013.
- ↑ Oxford Nanopore Launches MinION Access Program: #ASHG2013, NEXT GEN SEEK Making Sense of Next-Generation Sequencing Data (October 23, 2013). Проверено 15 ноября 2013.
- ↑ Products (англ.). nanoporetech.com. Проверено 7 июня 2018.
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .