
Марганцево-цинковый элемент, также известный как элемент Лекланше — это первичный химический источник тока, в котором катодом является диоксид марганца MnO2 (пиролюзит) в смеси с графитом (около 9,5 %), электролитом — раствор хлорида аммония NH4Cl, анодом — металлический цинк Zn.
Является самым известным первичным элементом (батарея одноразового использования), который сегодня широко используется в переносных устройствах. Изначально элементы заполнялись жидким электролитом. В дальнейшем электролит стали загущать с помощью крахмалистых веществ — это позволяло сделать более практичные элементы питания, называемые сухими, в которых сведена к минимуму возможность вытекания электролита.
История изобретения
Первый марганцево-цинковый элемент был собран Ж. Лекланше в 1865 г.[1].
Характеристики
В этом разделе не хватает ссылок на источники информации. |
- Теоретическая энергоёмкость:
- Удельная энергоёмкость: 67—99 Вт∙час/кг
- Удельная энергоплотность: 122—263 Вт∙час/дм³.
- ЭДС: 1,51 В.
- Рабочая температура: от −40 до +55 °C.
Принцип действия

При потреблении тока электроны поступают через внешнюю электрическую цепь с цинкового электрода на угольный стержень. Происходят следующие реакции:
Анод: Zn → Zn 2+ + 2e−
На угольном стержне электроны расходуются на восстановление H3O+-ионов:
Катод: 2H3O+ + 2e− → H2 + 2H2O
Ионы H3O+ образуются в результате частичного протолиза NH4+-ионов электролита:
NH4+ + H2O ↔ H3O+ + NH3
При восстановлении H3O+-ионов образуется водород, который не может удалиться (корпус герметичен) и образует вокруг угольного стержня прослойку газа (поляризация угольного электрода). Ток медленно затухает. Чтобы избежать образования водорода, угольный электрод окружают слоем диоксида марганца (MnO2). В присутствии диоксида марганца H3O+-ионы восстанавливаются с образованием воды:
2MnO2 + 2H3O+ + 2e− → 2MnO (OH) + 2H2O
Таким способом избегают поляризации электрода, а диоксид марганца называют деполяризатором. Электролит NH4Cl диссоциирует и частично протолизируется. В общем:
2NH4Cl + 2H2O ↔ 2NH3 + 2H3O+ + 2Cl−
Образующиеся на катоде ионы Zn2+ поступают в раствор и образуют труднорастворимую соль:
В общем:
Общая реакция: Zn + 2MnO2 + 2NH4Cl → 2MnO (OH) + [Zn (NH3)2]Cl2 Во время разрядки цинковый стакан растворяется. Во избежание вытекания электролита или продуктов реакции цинковый стакан имеет запас по толщине или окружён железной защитной оболочкой.
Устройство
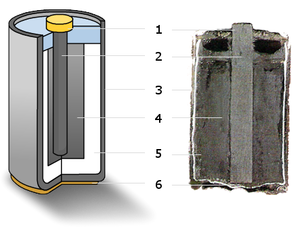
(1) — металлический колпачок,
(2) — графитовый электрод («+»),
(3) — цинковый стакан («—»),
(4) — оксид марганца,
(5) — электролит,
(6) — металлический контакт.
В качестве электродов в «сухом элементе» выступают цинковый стакан и угольный стержень. Поэтому сухой элемент называют ещё угольно-цинковым элементом. Положительным электродом «+» является угольный стержень, отрицательным — цинковый стакан. Угольный стержень окружен смесью диоксида марганца MnO2 и угля (сажи). В качестве электролита выступает раствор хлорида аммония NH4Cl с небольшой добавкой хлорида цинка ZnCl2, загущённый крахмалом и мукой — это необходимо для того, чтобы электролит не мог вытечь или высохнуть при хранении и эксплуатации элемента. Тем не менее при неправильной эксплуатации или слишком длительном хранении электролит всё же может потечь или высохнуть.
Производство
Этот раздел не завершён. |
Хранение и эксплуатация
Этот раздел не завершён. |

Восстановление работоспособности
По мере разрядки цинковый стакан покрывается слоем цинкдиамминхлорида, за счёт чего увеличивается внутреннее сопротивление элемента. Частично восстановить ёмкость элемента можно, если удалить слой цинкдиамминхлорида с поверхности цинкового стакана. Сделать это удаётся несколькими способами:
- путём деформации цинкового стакана
- подачей на выводы батареи переменного тока особой формы.
Второй способ нередко ошибочно называют перезарядкой. Стоит, однако, отметить, что оба способа сопряжены с риском повреждения цинкового стакана и подтекания электролита, а второй способ может также привести к взрыву элемента.
Другой распространённой причиной потери ёмкости является высыхание электролита. Это обычно происходит в тех случаях, когда элемент используется в течение длительного времени в устройствах, потребляющих небольшой ток (например, электронных часах), либо после длительного хранения. В этом случае восстановление работоспособности возможно после шприцевания батарейки водой, однако после необходимо плотно закрыть отверстие, иначе электролит может в скором времени снова высохнуть, либо начать подтекать.
Ещё одной известной неисправностью является коррозия (окисление) цинкового стакана. В результате окисления происходит истончение стакана, а также (при окислении контактных площадок) — увеличение сопротивления элемента. Коррозия в дальнейшем может также перекинуться на другие металлические детали, расположенные близко к батарее. Окислившийся элемент восстановлению не подлежит.
- Цинковый стаканчик («-» электрод) частично вскрыт, под ней бумажный стаканчик пропитанный электролитом и залитый битумной мастикой
- Цинковый стаканчик удалён, графитовый стержень («+» электрод) впрессованный в «+» контакт-крышку демонтирован
- Внутри бумажного стаканчика прессованный марганцево-угольный порошок с каналом для «+» электрода
Области применения
Все первичные источники тока, за исключением серебряно-цинкового, обладают большим внутренним сопротивлением - десятки Ом, не допускающим разряда их токами большой силы из-за чрезмерного падения напряжения на внутреннем сопротивлении. Это надо помнить при использовании их в качестве силовых источников тока.
Наиболее эффективной областью применения солевых батареек являются приборы со средним и низким энергопотреблением. Например, в ДУ пультах и часах. Это достигается за счет медленного саморазряда солевой батарейки в приборах с низким энергопотреблением (в сравнении с щелочными элементами питания).
Примечания
- ↑ Лекланше элемент — статья из Большой советской энциклопедии.
Литература
- Кромптон. Т. Первичные источники тока. Москва. «Мир». 1986 г.
- ГОСТ 15596-82 Источники тока химические. Термины и определения
Ссылки
В этой статье или разделе имеется список источников или внешних ссылок, но источники отдельных утверждений остаются неясными из-за отсутствия сносок. |
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .



