| Доцетаксел | |
|---|---|
| Docetaxel | |
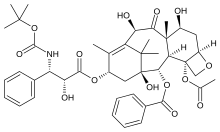 Доцетаксел | |
| Химическое соединение | |
| ИЮПАК | (2R,3S)-N-Карбокси-3-фенилизосерин-N-трет-бутил-13-5бета,20-эпокси-1,2альфа,4,7бета,10бета,13альфа-гексагидрокситакс-11-ен-9-он-4- ацетат-2-бензоата тригидрат |
| Брутто-формула | C43H53NO14 |
| Молярная масса | 807.879 г/моль |
| CAS | 114977-28-5 |
| PubChem | 148124 |
| DrugBank | APRD00932 |
| Классификация | |
| АТХ | L01CD02 |
| Фармакокинетика | |
| Биодоступн. | NA |
| Связывание с белками плазмы | >98% |
| Метаболизм | Hepatic |
| Период полувывед. | 86 часов |
| Экскреция | Biliary |
| Лекарственные формы | |
| концентрат для приготовления раствора для инфузий | |
| Другие названия | |
| Доцетаксел, Доцетера, Таксотер®, Таутакс | |
Доцетаксел — полусинтетическое цитостатическое лекарственное средство растительного происхождения из группы таксанов, получаемое путем химического синтеза из природного сырья — из игл тиса европейского (Taxus baccata).
Фармакологическое действие
Активное вещество препарата — доцетаксел — накапливает тубулин в микротрубочках, препятствует их распаду, что приводит к нарушению фазы митоза и межфазных процессов в опухолевых клетках. Доцетаксел долго сохраняется в клетках, где достигаются его высокие концентрации. Доцетаксел активен в отношении некоторых (но не всех) клеток, продуцирующих в избыточном количестве р-гликопротеин, который кодируется геном множественной устойчивости. In vivo доцетаксел имеет широкий спектр активности в отношении опухолей мышей и перевиваемых опухолевых клеток человека.
Фармакокинетика
Фармакокинетика доцетаксела является дозозависимой и соответствует трехфазной фармакокинетической модели с T1/2 4 мин, 36 мин и 11.4 ч соответственно. Связывание с белками плазмы составляет 95 %. В течение 7 дней доцетаксел выводится с мочой и калом после окисления терт-бутиловой эфирной группы с участием цитохрома Р450. Выведение с мочой составляет 6 % радиоактивной дозы, с калом — 75 %. Примерно 80 % радиоактивного препарата, выводимого с калом, обнаружено в течение 48 ч в виде основного неактивного метаболита и трех менее значимых неактивных метаболитов и, в очень незначительном количестве, в неизмененном виде.
Фармакокинетика в особых клинических случаях
Фармакокинетика доцетаксела не зависит от возраста и пола пациента. Исследование, проведенное на небольшом числе больных с признаками легко выраженного нарушения функции печени (уровни АСТ и АЛТ>=1.5 ВГН в сочетании с повышением активности ЩФ>=2.5 ВГН), показало снижение общего клиренса на 27 % по сравнению со средним показателем. Клиренс доцетаксела не менялся у больных с легкой или умеренной задержкой жидкости (данных о клиренсе препарата у пациентов с выраженной задержкой жидкости нет).
Показания
В этом разделе не хватает ссылок на источники информации. |
- адъювантная терапия при операбельном раке молочной железы с поражением регионарных лимфоузлов в комбинации с доксорубицином и циклофосфамидом;
- местно распространенный или метастатический рак молочной железы (в комбинации с доксорубицином в качестве первичного химиотерапевтического лечения (1-я линия); или в качестве терапии 2-й линии: в монотерапии, при неэффективности предшествующего лечения, включавшего в себя антрациклины или алкилирующие средства, и в комбинации с капецитабином, если предшествующее лечение включало в себя антрациклины);
- метастатический рак молочной железы с опухолевой экспрессией НЕR2 в комбинации с трастузумабом, в случае отсутствия предшествующей химиотерапии;
- неоперабельный, местно распространенный или метастатический немелкоклеточный рак легких (в комбинации с цисплатином или карбоплатином) в качестве терапии 1-й линии или в монотерапии в качестве терапии 2-й линии при неэффективности химиотерапии, основанной на препаратах платины;
- метастатический рак яичников при неэффективности предшествующей терапии 1-й линии (терапия 2-й линии);
- метастатические плоскоклеточные злокачественные опухоли области головы и шеи при неэффективности предшествующего лечения (терапия 2-й линии)
- метастатический, гормонорезистентный рак предстательной железы (в комбинации с преднизоном или преднизолоном).
Режим дозирования
Для предупреждения реакций повышенной чувствительности, а также с целью уменьшения задержки жидкости всем больным до введения препарата доцетаксел должна проводиться премедикация ГКС, например, дексаметазоном в дозе 16 мг/сут (по 8 мг 2 раза/сут) внутрь, в течение 3 дней, начиная за 1 день до введения доцетаксела. Доцетаксел вводится в виде одночасовой внутривенной инфузии. При раке молочной железы доцетаксел вводят в дозе 100 мг/м2 при монотерапии и 75 мг/м2 в комбинации с доксорубицином (50 мг/м2) или капецитабином (1250 мг/м2 внутрь 2 раза/сут в течение 2 недель с последующим недельным перерывом) каждые 3 недели. При немелкоклеточном раке легкого доцетаксел вводят в дозе 75 мг/м2 при монотерапии и 75 мг/м2 в комбинации с препаратами платины каждые 3 недели. При метастатическом раке яичников доцетаксел вводят в дозе 100 мг/м2 каждые 3 недели. При метастатическом плоскоклеточном раке тканей головы и шеи доцетаксел вводят в дозе 100 мг/м2 каждые 3 недели.
Коррекция дозы
При монотерапии рака молочной железы доцетаксел вводится при количестве нейтрофилов >=1500/мкл. При падении числа нейтрофилов <500/мкл, которое наблюдалось более недели, или развитии фебрильной нейтропении, или развитии выраженных кожных реакций, или выраженной периферической невропатии во время терапии доцетакселом, дозу этого препарата для следующих введений следует снизить со 100 до 75 мг/м2 и/или с 75 до 60 мг/м2. Если подобные осложнения возникают и при применении доцетаксела в дозе 60 мг/м2, лечение следует прекратить.
При комбинированной терапии рака молочной железы при первом появлении токсичности 2 степени, которая сохраняется до времени проведения следующего цикла лечения доцетаксел/капецитабином, следующий цикл лечения может быть отложен до снижения токсичности до 0-1 степени, во время следующего цикла лечения вводится 100 % первоначальной дозы доцетаксела.
У пациентов с повторным развитием токсичности 2 степени или первым развитием токсичности 3 степени в любое время цикла лечения, лечение откладывается до снижения токсичности до 0-1 степени, затем лечение Таксотером возобновляется в дозе 55 мг/м2.
При любых последующих проявлениях токсичности или появлении любых видов токсичности 4 степени введение Таксотера должно быть прекращено.
В отношении коррекции дозы капецитабина при его сочетании с доцетакселом необходимо следовать инструкции по применению капецитабина.
При комбинированной терапии немелкоклеточного рака легких для пациентов, которые первоначально получают доцетаксел в дозе 75 мг/м2 в комбинации с цисплатином, у которых количество тромбоцитов в предыдущем цикле лечения снижалось до <25 000/мкл, или у пациентов, у которых развилась фебрильная нейтропения, или у пациентов с серьезными проявлениями негематологической токсичности доза доцетаксела в следующем цикле должна быть снижена до 65 мг/м2. При коррекции дозы цисплатина следует следовать инструкции по применению цисплатина.
В качестве альтернативы у пациентов, у которых развилась фебрильная нейтропения или тяжелая инфекция в течение последнего из проведенных циклов, возможно использование гранулоцитарного колониестимулирующего фактора для того, чтобы было можно поддерживать интенсивность режима дозирования, необходимую с клинической точки зрения.
Для пациентов с нарушениями функции печени при уровне АЛТ или АСТ, превышающем более, чем в 1.5 раза верхнюю границу нормы (ВГН), или уровне ЩФ, превышающем более, чем в 2.5 раза ВГН, рекомендуемая доза составляет 75 мг/м2. У больных с повышенным уровнем билирубина и/или повышенной активностью АЛТ и АСТ (>3.5 ВГН) в сочетании с повышением уровня ЩФ (>6 ВГН), применять доцетаксел не рекомендуется.
В настоящее время отсутствуют данные относительно применения доцетаксел в комбинации с другими лекарственными препаратами у больных с нарушениями функции печени.
С учетом анализа фармакокинетических данных какие-либо специальные инструкции по применению доцетаксела у пожилых пациентов отсутствуют.
Правила приготовления раствора
Концентрат для приготовления инфузионного раствора для парентерального применения следует разводить.
Приготовление предварительно смешанного раствора доцетаксела 10 мг/мл
Перед разведением флаконы с препаратом и растворителем необходимо в течение 5 мин подержать при комнатной температуре. Все содержимое флакона с растворителем набирается с помощью иглы в шприц (флакон размещается слегка под углом) и вводится во флакон доцетаксела. Флакон с полученной смесью переворачивается в течение 45 с (не встряхивать!) и оставляется на 5 мин при комнатной температуре, после чего раствор проверяется на гомогенность и прозрачность (наличие пены даже через 5 мин является нормой). Предварительно смешанный раствор содержит доцетаксел 10 мг/мл и должен использоваться немедленно для приготовления раствора для инфузий.
Приготовление раствора для инфузий
Необходимый объем предварительно смешанного раствора в соответствии с требуемой дозой вводится в мешок для инфузий или флакон, содержащий 250 мл 5 % раствора декстрозы или 0.9 % раствора натрия хлорида. Если требуемая доза доцетаксела превышает 200 мг, то следует использовать больший объем жидкости для инфузий, чтобы концентрация доцетаксела не была выше 0.74 мг/мл. Необходимо перемешать содержимое мешка для инфузий или флакона. Полученный раствор следует использовать в течение 4 ч для внутривенной одночасовой инфузии при комнатной температуре и обычных условиях освещенности. Предварительно смешанный раствор доцетаксела и раствор для инфузий необходимо осматривать перед введением; при наличии осадка раствор следует уничтожать.
Побочное действие
Со стороны системы кроветворения
Часто — обратимая нейтропения, в ряде случаев сопровождающаяся лихорадкой. Число нейтрофилов снижается до минимальных значений в среднем в течение 7 дней (у пациентов, получавших ранее химиотерапию, этот период может быть короче), средняя продолжительность выраженной нейтропении (<500 в мкл) составляет 7 дней. Отмечены случаи тромбоцитопении и анемии.
Аллергические реакции
Умеренно выраженные реакции повышенной чувствительности обычно возникают в течение нескольких минут после начала инфузии (приливы, сыпь, зуд, чувство стеснения в груди, боль в спине, одышка, лекарственная лихорадка, озноб). Крайне редко - синдром Лайелла, синдром Стивенса-Джонсона. Возможно развитие тяжелых реакций (артериальная гипотония, бронхоспазм, генерализованная сыпь и эритема), которые исчезали после прекращения инфузии и назначения адекватной терапии.
Дерматологические реакции
Алопеция, легкие и умеренно выраженные кожные реакции. Редко встречались выраженные реакции - сыпь, сопровождающаяся зудом, или ограниченная эритема кожи ладоней и стоп с отёком и последующей десквамацией (в некоторых случаях может потребоваться прерывание или прекращение терапии), гипо- или гиперпигментация ногтей, онихолизис.
Со стороны пищеварительной системы
Тошнота, рвота, диарея, анорексия, запор, стоматит, нарушение вкуса, эзофагит, боли в эпигастрии; редко - желудочно-кишечные кровотечения; в единичных случаях - кишечная непроходимость.
Со стороны печени
У пациентов, получавших монотерапию доцетакселом в дозе 100 мг/м2, повышение активности АЛТ, АСТ, ЩФ и уровня билирубина в сыворотке крови, более чем в 2.5 раза превышающих ВГН, отмечалось менее чем в 5 % случаев.
Со стороны сердечно-сосудистой системы
Нарушения сердечного ритма (синусовая тахикардия, мерцательная аритмия), нестабильная стенокардия, сердечная недостаточность, артериальная гипо- или гипертензия. Крайне редко отмечались случаи венозной тромбоэмболии и инфаркта миокарда.
Со стороны периферической нервной системы
Периферическая невропатия (в виде легко или слабо выраженных парестезий, гиперестезий, дизестезии, болей /в том числе чувство жжения/), слабость. Обратимое развитие этих изменений в течение 3 мес отмечалось у 35.3 % больных, получавших лечение доцетакселом в дозе 100 мг/м2. В единичных случаях отмечались судороги и преходящая потеря сознания.
Местные реакции
Умеренно-выраженные - гиперпигментация, воспаление, покраснение, сухость кожи, флебит, кровоизлияние, отёк вен.
Задержка жидкости
Описаны случаи развития периферических отёков, плеврального или перикардиального выпота, асцита, увеличения массы тела. Периферические отеки обычно появляются на нижних конечностях, а затем могут стать генерализованными, приводя к увеличению массы тела на 3 кг и более. Частота и выраженность задержки жидкости увеличиваются при повторном введении препарата; средние суммарные дозы доцетаксела, при которых наблюдалась задержка жидкости, составляли при проведении премедикации 818.9 мг/м2, и 489.7 мг/м2 - без проведения премедикации. Однако в некоторых случаях отёки возникали во время первых курсов терапии. Задержка жидкости не сопровождалась острыми эпизодами олигурии или артериальной гипотензии. В редких случаях сообщалось о развитии дегидратации и отёка лёгких.
Прочие
Артралгия, миалгия, астения, мышечная слабость, одышка, генерализованные или локальные боли, включая боли в грудной клетке, не связанные с заболеваниями сердца или легких, сепсис. Редко возможно развитие слезотечения в сочетании с конъюнктивитом (или без него); в единичных случаях - у пациентов, получающих одновременно другие противоопухолевые препараты, возможно развитие окклюзии слезного канала, приводящей к чрезмерному слезотечению.
Также редко отмечались преходящие визуальные расстройства (вспышки света в глазах, появление скотом), обычно возникающие во время введения препарата и сочетающиеся с развитием реакций гиперчувствительности, которые исчезали после прекращения инфузии.
В единичных случаях отмечалось развитие острого респираторного дистресс-синдрома, интерстициальной пневмонии, легочного фиброза и усиление реакции на облучение.
При применении доцетаксела в комбинации с капецитабином наблюдалось более частое развитие нежелательных явлений со стороны пищеварительной системы, ладонно-стопного синдрома (гиперемия кожи конечностей /ладоней и стоп/ с последующим отеком и десквамацией), дегидратации, слезотечения, артралгии, тяжелых тромбоцитопений и анемии, гипербилирубинемии, но более редкое развитие тяжелой нейтропении, алопеции, нарушений со стороны ногтей, астении, миалгии, отеков нижних конечностей.
У пациентов в возрасте старше 60 лет, получавших комбинированную терапию Таксотером и капецитабином, по сравнению с пациентами более молодого возраста отмечается более частое развитие токсичности 3-4 степени.
Противопоказания
- указания в анамнезе на реакции повышенной чувствительности на доцетаксел или другие компоненты препарата;
- выраженные нарушения функции печени;
- исходное число нейтрофилов <1500/мкл;
- беременность;
- период кормления грудью.
Беременность и лактация
Таксотер противопоказан к применению при беременности и в период лактации (грудного вскармливания). Пациентки детородного возраста должны избегать зачатия во время применения препарата и, как минимум, в течение 3 мес после его отмены.
Особые указания
В ходе международных клинических исследований установлена высокая эффективность доцетаксела в лечении гормонорезистентного рака предстательной железы, рака желудка и ранних стадий рака молочной железы.
Лечение доцетакселом проводится только при участии опытного специалиста по противоопухолевой химиотерапии в условиях специализированного стационара или отделения.
При развитии выраженной нейтропении (<500/мкл в течение 7 дней и более) во время курса терапии доцетаксела рекомендуется снизить дозу препарата при последующих курсах или использовать адекватные симптоматические меры.
С целью выявления реакций повышенной чувствительности больных следует тщательно наблюдать, особенно во время первой и второй инфузий. Развитие реакций повышенной чувствительности возможно на первых минутах инфузии доцетаксела. Легкие проявления гиперчувствительности (покраснение лица, локализованные кожные реакции) не требуют прерывания терапии. Однако тяжелые реакции повышенной чувствительности (артериальная гипотензия, бронхоспазм, генерализованная сыпь, эритема) требуют немедленной отмены введения препарата и проведения соответствующих лечебных мероприятий. Повторное назначение доцетаксела не разрешается.
У больных, получающих монотерапию доцетакселом в дозе 100 мг/м2 и имеющих высокую активность АЛТ и/или АСТ, более чем в 1.5 раза превышающих ВГН, в сочетании с повышенным уровнем ЩФ более чем в 2.5 раза выше ВГН, крайне высок риск развития тяжелых побочных эффектов: сепсис, желудочно-кишечные кровотечения, фебрильная нейтропения, инфекции, тромбоцитопения, стоматит, астения. В связи с этим у таких больных с повышенными показателями функции печени рекомендуемая доза доцетаксела составляет 75 мг/м2; функциональные пробы печени должны определяться до начала проведения терапии и перед каждым последующим циклом терапии доцетакселом. У больных с повышенным уровнем билирубина и/или повышенной активностью АЛТ и АСТ (>3.5 ВГН) в сочетании с повышением уровня ЩФ (>6 ВГН), доцетаксел назначать не рекомендуют. В настоящий момент отсутствуют данные относительно применения доцетаксела в комбинации с другими препаратами у больных с нарушениями функции печени.
В связи с возможностью развития отечного синдрома необходимо наблюдать за пациентами с асцитом, выпотом в плевральную полость или перикард. При появлении отеков показано ограничение соли и питьевого режима и назначение диуретиков.
При приготовлении раствора доцетаксела следует соблюдать меры предосторожности. Необходимо пользоваться перчатками, маской и очками.
При попадании концентрата, предварительно смешанного раствора или раствора для инфузий на кожу следует сразу же промыть её водой с мылом. При попадании концентрата, предварительно смешанного раствора или раствора для инфузий на слизистые оболочки следует немедленно промыть их водой.
Контроль лабораторных показателей
Необходим систематический контроль картины периферической крови с целью своевременного выявления миелотоксичности.
Использование в педиатрии
Безопасность и эффективность применения доцетаксела у детей изучена недостаточно. Имеется ограниченный опыт применения доцетаксела у детей.
Передозировка
Симптомы
Подавление функции костного мозга, периферическая невропатия, воспаление слизистых оболочек.
Лечение
Специфического антидота нет. Назначают Г-КСФ (гранулоцитарный колониестимулирующий фактор). При необходимости проводят симптоматическую терапию.
Лекарственное взаимодействие
Исследования in vitro показали, что биотрансформация препарата может измениться при одновременном применении веществ, индуцирующих, ингибирующих или метаболизирующихся изоферментом CYP3A4 системы цитохрома Р450 (циклоспорин, терфенадин, кетоконазол, эритромицин, тролеандомицин). В связи с этим необходимо соблюдать осторожность при одновременном назначении с подобными препаратами, учитывая возможность взаимодействия.
In vitro лекарственные средства, характеризующиеся высоким связыванием с белками, такие как эритромицин, дифенгидрамин, пропранолол, пропафенон, фенитоин, салицилат, сульфаметоксазол, натрия вальпроат, не влияли на связывание доцетаксела с белками.
Доцетаксел не влияет на связывание дигитоксина.
Фармакокинетическое взаимодействие
При использовании доцетаксела в комбинации с доксорубицином клиренс доцетаксела увеличивался при сохранении его эффективности.
При этом клиренс доксорубицина и уровень доксорубицинола (метаболита доксорубицина) в плазме не изменялся.
Клиренс доцетаксела в комбинации с цисплатином или карбоплатином был подобным таковому, наблюдаемому при монотерапии доцетакселом. Фармакокинетический профиль цисплатина при его введении сразу же после внутривенной инфузии доцетаксела был подобен таковому, наблюдаемому при введении одного цисплатина.
Не выявлено влияния доцетаксела на фармакокинетику (Cmax, AUC) главного метаболита капецитабина (5DFUR) и влияния капецитабина на фармакокинетику (Cmax, AUC) доцетаксела.
Условия и сроки хранения
При температуре от +2 °C до +8 °C в защищенном от света и недоступном для детей месте. Для доцетаксела 20 мг - 24 месяца., доцетаксела 80 мг – 36 месяцев. Предварительно смешанный раствор доцетаксела рекомендуется использовать сразу после приготовления. Раствор для инфузии следует использовать в течение 4 ч (включая часовую инфузию) при комнатной температуре и в обычных условиях освещенности.
Ссылки
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .