| 2-Меркаптоэтанол | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
2-сульфанилэтан-1-ол |
| Хим. формула | С2H6SO |
| Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 78,133 г/моль |
| Плотность | 1,114 г/см³ |
| Термические свойства | |
| Т. плав. | −100 °C |
| Т. кип. | 157 °C |
| Классификация | |
| Рег. номер CAS | 60-24-2 |
| PubChem | 1567 |
| Рег. номер EINECS | 200-464-6 |
| SMILES | |
| InChI | |
| RTECS | KL5600000 |
| ChEBI | 41218 |
| Номер ООН | 2966 |
| ChemSpider | 1512 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
2-меркаптоэтанол (β-меркаптоэтанол, BME, 2BME, 2-ME, β-met) — химическое сераорганическое соединение, производное этиленгликоля и этандитиола. Восстанавливающий агент, используемый для восстановления дисульфидных связей. Антиоксидант, используемый для деактивации свободных радикалов. Широко используется, так как гидроксильная группа обеспечивает хорошую растворимость в воде и снижает летучесть. Как и большинство тиолов имеет отвратительный запах.
Синтез
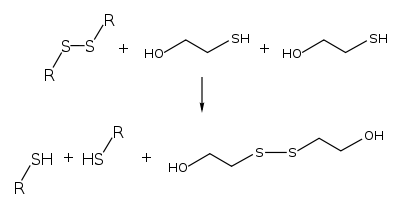
2-меркаптоэтанол может быть синтезирован в реакции сероводорода с оксидом этилена[1]:
Химические свойства
2-меркаптоэтанол взаимодействует с альдегидами и кетонами. Данная реакция делает меркаптоэтанол важной защитной группой[2].
Применение
Восстановление дисульфидных связей в белках
Некоторые белки денатурируют в присутствие 2-меркаптоэтанола из-за восстановления дисульфидных связей:
Восстановление дисульфидных связей приводит к разрушению третичной и четвертичной структуры белков.[3] Поэтому меркаптоэтанол часто используют при исследовании структуры белков, например, для перевода всех молекул белка из олигомерного в мономерное состояние. Однако, из-за того, что 2-меркаптоэтанол образует аддукты со свободными цистеинами и является более токсичным, чем дитиотреитол, в молекулярной биологии и биохимии чаще используют последний, особенно при анализе белков в полиакриламидном геле. Дитиотреитол также является более мощным восстановителем, и имеет при рН 7 восстановительный потенциал −0,33 В, в то время как 2-меркаптоэтанол −0,26 В.[4]
В биохимических исследованиях также используют трис(2-карбоксиэтил)фосфин (англ. TCEP), который не обладает неприятным запахом.
2-меркаптоэтанол более стабилен, чем дитиотреитол (2-ME: t1/2>100 часов при pH 6,5, t1/2=4 часа при рН 8,5; DTT: t1/2=40 часов при pH 6,5, t1/2=1,5 часа при pH 8,5; Stevens et al., 1983), но более летуч.[5]
Предотвращение окисления белков
2-меркаптоэтанол и другие восстанавливающие агенты добавляют к компонентам ферментативных реакций для ингибирования окисления свободных сульфогидрильных остатков и поддержания белковой активности.
Денатурирование рибонуклеаз
2-меркаптоэтанол используют при выделении РНК для элиминирования РНКазы, которая освобождается при разрушении клеток. Дисульфидные связи делают РНКазу очень стабильным ферментов, 2-меркаптоэтанол восстанавливает эти связи и необратимо денатурирует эти белки. Такая обработка препятствует расщеплению РНК в процессе выделения[6].
Безопасность
2-меркаптоэтанол является токсичным веществом, вызывает раздражение дыхательных путей, кожи, боли в животе и потенциально может приводить к смертельному исходу[7].
Примечания
- ↑ Knight, J. J. «2-Mercaptoethanol» in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
- ↑ 1,3-Dithiolanes, 1,3-Dithianes. Organic Chemistry Portal. Проверено 27 мая 2008. Архивировано 17 мая 2008 года.
- ↑ 2-Mercaptoethanol. Chemicalland21.com. Проверено 8 октября 2006. Архивировано 5 октября 2006 года.
- ↑ Aitken CE, Marshall RA, Puglisi JD (2008). “An oxygen scavenging system for improvement of dye stability in single-molecule fluorescence experiments”. Biophys J. 94 (5): 1826—35. DOI:10.1529/biophysj.107.117689. PMC 2242739. PMID 17921203.
- ↑ Yeh, J. I. «Additives and microcalorimetric approaches for optimization of crystallization» in Protein Crystallization, 2nd Edition (Ed: T. Bergfors) 2009, International University Line, La Jolla, CA. ISBN 9780972077446.
- ↑ Nelson, David R.; Lehninger, Albert L; Cox, Michael. Lehninger principles of biochemistry. — New York : W.H. Freeman, 2005. — P. 148.
- ↑ Material Safety Data Sheet. JT Baker. Проверено 31 июля 2011. Архивировано 16 сентября 2012 года.
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .